Hensikten med ALITHIOS-studien er å undersøke langsiktig sikkerhet, effekt, og tolerabilitet av Kesimpta®-behandling.1
ALITHIOS er en pågående fase 3b, ublindet forlengelsesstudie. Studien inkluderer personer med relapserende MS med enten relapserende remitterende MS (RRMS) eller aktiv sekundær progressiv MS. Deltakerne hadde ved inkludering deltatt i en av de fire tidligere studiene i Kesimpta®-studieprogrammet: ASCLEPIOS I, ASCLEPIOS II, APLIOS eller APOLITOS. Deltakerne ble kategorisert som kontinuerlig behandlet om de hadde fått Kesimpta®-behandling før start av ALITHIOS, og som nylig byttet om de ikke hadde stått på Kesimpta®. Den totale gruppen av deltakere i ALITHIOS har fått benevnelsen «den totale sikkerhetspopulasjonen».2
Etter de fullførte fase 3 ASCLEPIOS-studiene på personer med relapserende MS, så var gjennomsnittlig eksponering i den samlede Kesimpta®-gruppen (n=946) 574,0 dager, eller omtrent 1,5 år. Den pågående forlengelsesstudien ALITHIOS gir langsiktige sikkerhets- og tolerabilitetsdata med ofatumumab utover det som ble samlet inn i fase 3-randomiserte studiene. Når den er fullført, vil studien gi data for pasienter opp til 5 år på behandling med ofatumumab.
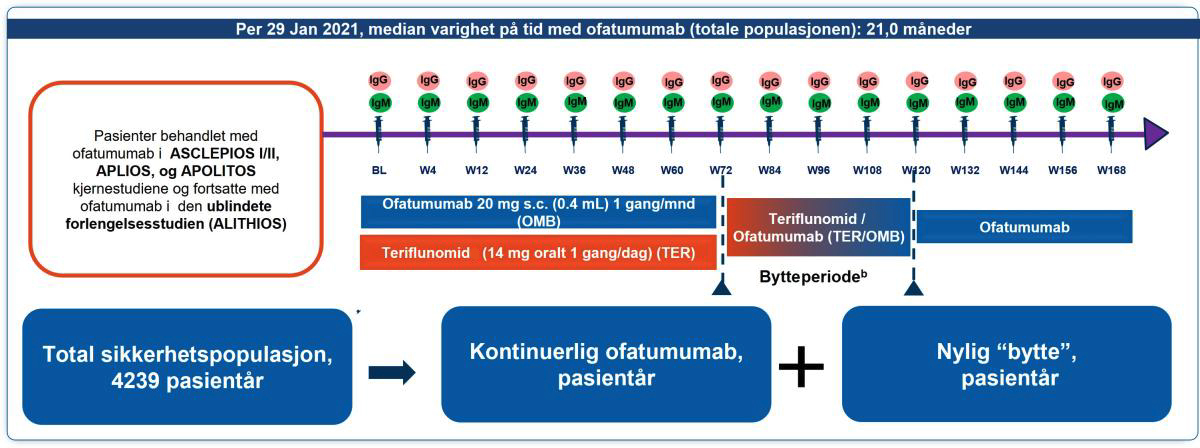
Figur 1: Studiedesign på ALITHIOS-studien. Pasienter som fullførte ASCLEPIOS I/II (fase 3), APLIOS eller APOLITOS (fase 2) studier kunne gå inn i ALITHIOS fase 3b, ublindet, langsiktig sikkerhetsstudie. Kumulative data for kontinuerlig ofatumumab-behandling og pasienter som nylig har byttet fra teriflunomid ble så analysert.
Publiserte 3,5-årsdata på den totale sikkerhetspopulasjonen inkluderte 1969 deltakere, derav 1292 kontinuerlig behandlete gruppen med Kesimpta®, og 677 i den nylig byttet Kesimpta®-gruppen.
Den totale sikkerhetspopulasjonen ved baseline hadde snittalder på 37,7 år og gjennomsnittlig EDSS skår på 2,9 (Tabell 1).
Tabell 1: Baseline demografi og sykdomskarakterstika.
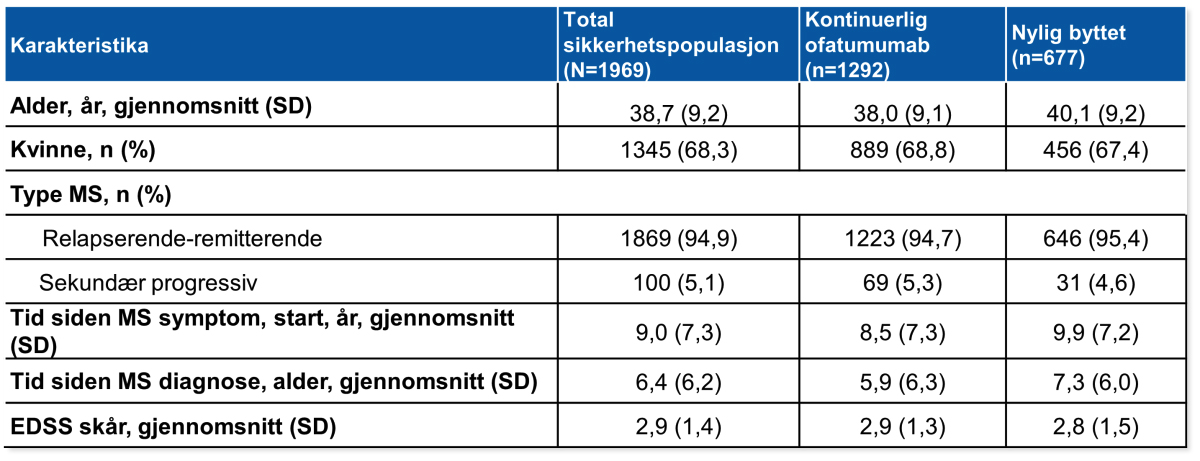
Dataene i tabellen ovenfor er baseline-verdier som tilsvarer den siste ikke-manglende verdien før første administrasjon av Kesimpta®. For pasienter i den nylig byttet gruppen, refererer baseline til tiden før første administrasjon av Kesimpta® i ALITHIOS forlengelsesstudien. EDSS-skårene varierer fra 0,0 til 10,0, med høyere skår som indikerer forverring av funksjonshemming; EDSS, Expanded Disability Status Scale; MS, multippel sklerose; SD, standardavvik.
Ingen nye risikofaktorer assosiert med langsiktigbehandling med ofatumumab ble identifisert i den totale sikkerhetspopulasjonen som ikke var kjent fra tidligere (Tabell 2).
Bivirkninger som førte til seponering av ofatumumab forekom hos 115 pasienter (5,8 %) i den totale sikkerhetspopulasjonen (kontinuerlig ofatumumab-gruppe, n=89 [6,9 %]; nylig byttet ofatumumab-gruppe, n=26 [3,8 %]).
Tabell 2: Rapporterte bivirkninger i løpet av 3,5 år. Tabell utarbeidet av Novartis basert på Hauser et al.2
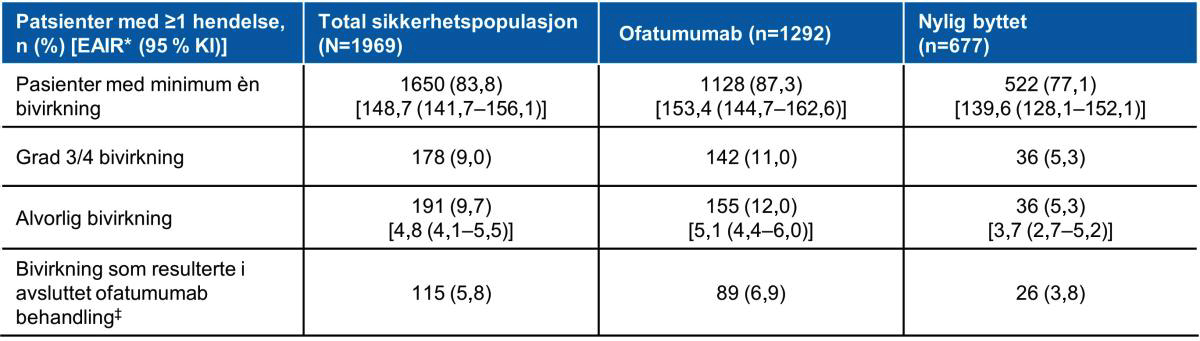
*EAIR er definert som antall pasienter med en bestemt AE delt på den totale eksponeringstiden blant pasienter i den respektive behandlingsgruppen med risiko for en første forekomst av hendelsen. ‡Reduserte IgM-nivåer var den vanligste årsaken til seponering av Kesimpta®.
De hyppigste infeksjonene i den totale sikkerhetspopulasjonen er vist i figur 3. Ingen oportunistiske infeksjoner, hepatitt B reaktivering, eller progressiv multifocal leukoencefalopati hendelser ble identifisert. Insidensen av infeksjoner i den totale sikkerhetspopulasjonen er tilsvarende til ofatumumab gruppen i ASCLEPIOS I/II studiene.2
Tabell 3: De hyppigste infeksjonene i den totale sikkerhetspopulasjonen. Tabell utarbeidet av Novartis basert på Hauser et al.2
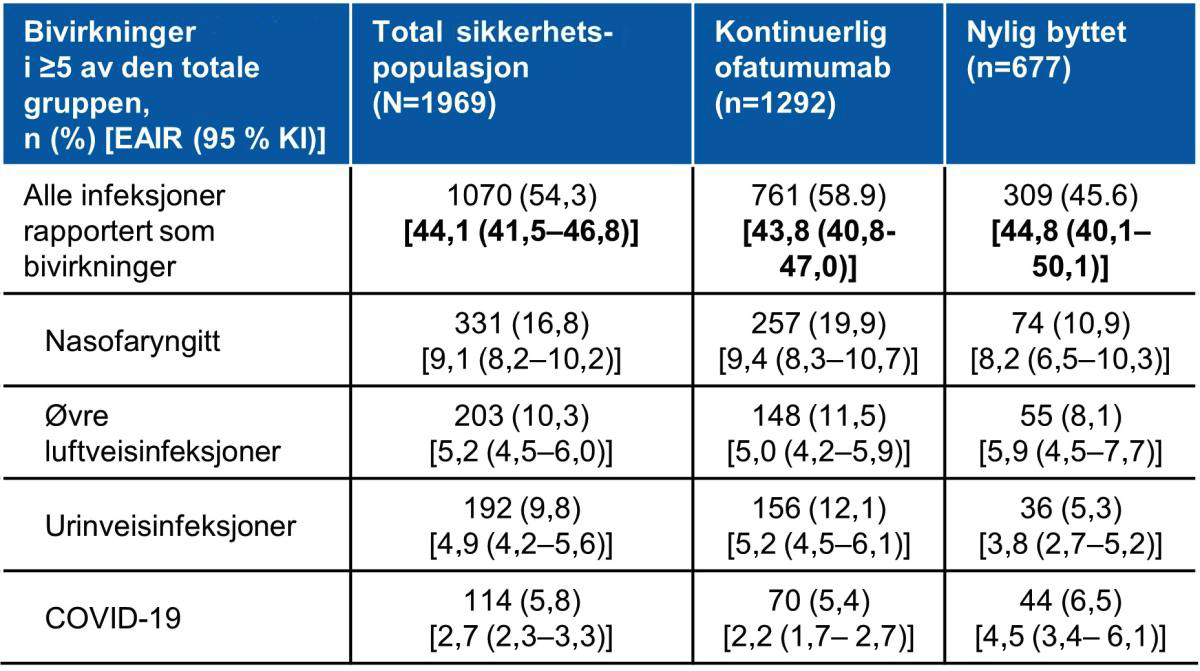
De hyppigste infeksjonene. KI, konfidensintervall; EAIR, exposure adjusted incidence rate.
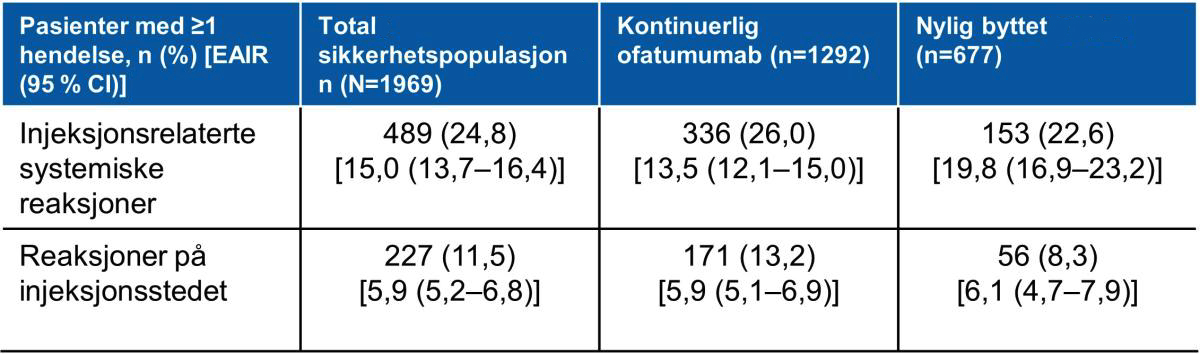
Systemiske reaksjoner og reaksjoner på injeksjonsstedet var for det meste milde til moderate i alvorlighetsgrad og ikke-alvorlige (Tabell 4).
Tabell 4: Oversikt over injeksjonsrelaterte systemiske reaksjoner og reaksjoner på injeksjonsstedet. Tabell utarbeidet av Novartis basert på Hauser et al.2
Gjennomsnittlig serum IgG nivå forble stabile. Gjennomsnittlig IgM-nivå ble redusert, men forble over nedre referanseverdi (0,40 g/l) hos de fleste pasientene. Det var ingen assosiasjon mellom redusert immunglobulin-nivå og risiko for alvorlige infeksjoner. Prosent forandring i IgG og IgM-nivå fra baseline i ALITHIOS var henholdsvis +1,1 % og −47 % ved uke 168 (kontinuerlig gruppe) (Figur 2).2
Resultatene på immunglobuliner er tilsvarende resultat med 96-ukers behandling med Kesimpta som ble observert i fase 3 studiene ASCLEPIOS I og II.2
Generelt var antallet alvorlige infeksjoner lavt i ALITHIOS. I den totale sikkerhetspopulasjonen var andelen (antall) pasienter med alvorlig infeksjon innen 1 måned før eller etter en eventuell nedgang i IgG 3,3 % (1/30) hos pasienter som hadde IgG-nivåer under nedre referanseverdi (LLN: 5,65 g/l), når som helst etter baseline, og 2,8 % (55/1936) hos de hvis nivåer forble lik eller over nedre referanseverdi (LLN). Tilsvarende verdier for IgM var 0,7 % (3/454) hos pasienter med IgM-nivåer under nedre referanseverdi (LLN: 0,40 g/l) til enhver tid post-baseline og 2,9 % (44/1512) hos pasienter hvis IgM-nivå forble lik eller over nedre referanseverdi (LLN). En pasient med IgG-nivåer under nedre referanseverdi (LLN) hadde en alvorlig infeksjon (lungebetennelse). Tre pasienter med IgM-nivåer som til enhver tid var under nedre referanseverdi (LLN) hadde en alvorlig infeksjon (herpes zoster; øvre luftveisinfeksjon; urinveisinfeksjon).2
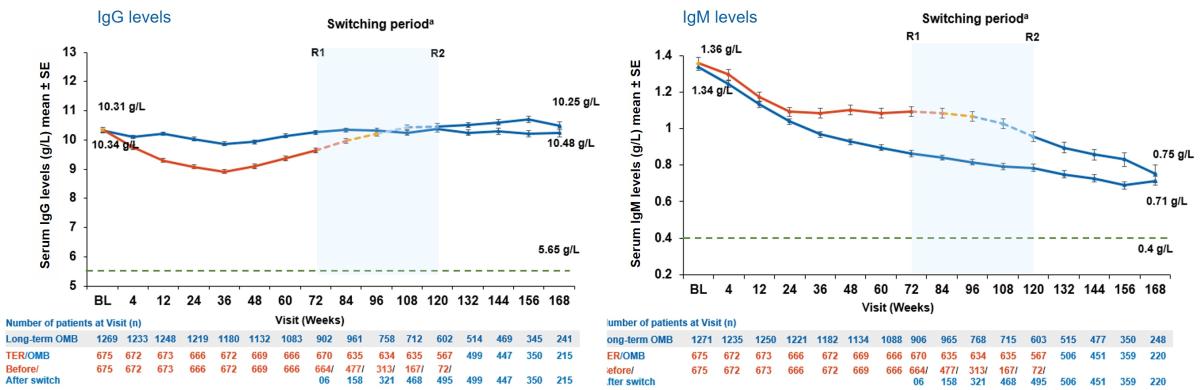
Figur 2: Gjennomsnittlig serum IgG nivå forble stabile, IgM nivå ble redusert, men forble over nedre referanseverdi hos de fleste pasientene behandlet med ofatumumab. Figur utarbeidet av Novartis basert på Hauser et al.2
a: Switch period [bytteperiode] refererer til pasienter som startet med teriflunomid og ikke aktuelt for pasienter med ofatumumab i kjerneperioden; For TER/OMB-gruppen er data fra den første dosen av TER til siste dose av OMB pluss 100 dager/tidspunkt for analyse blitt brukt. b: Kvartiler for IgG (g/L) Q1: 8,57, Q2: 10,07 og Q3: 11,51
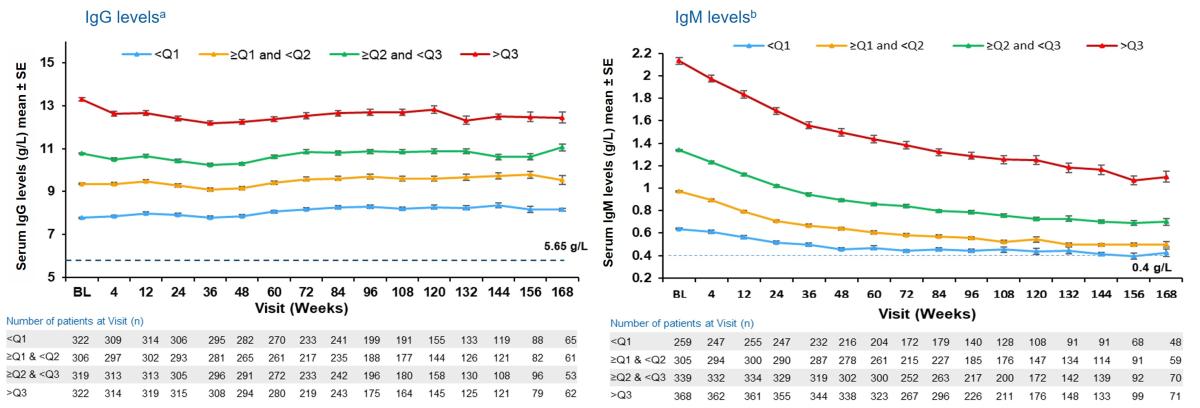
Figur 3: OgG/IgG -nivå hos ofatumumab-behandlete pasienter opptil 3,5 år etter baseline kvartiler. IgG-nivåer forble lik grunnlinjeverdiene (baseline) i alle kvartiler gjennom hele behandlingsperioden.IgM-nivåer sank over tid; gjennomsnittsverdiene forble over nedre referanseverdi (LLN) med den minste reduksjonen observert for den laveste kvartilgruppen (<0,81 g/l). Figur utarbeidet av Novartis basert på Hauser et al.2
a: Switching peiod [bytteperiode] refererer til pasienter som startet med teriflunomid og var ikke aktuelt for pasienter med ofatumumab i kjerneperioden; For TER/OMB-gruppen er data fra den første dosen av TER til siste dose av OMB pluss 100 dager/tidspunkt for analyse blitt brukt. b: Kvartiler for IgG (g/l) Q1: 8,57, Q2: 10,07 og Q3: 11,51.
Langsiktig OMB, N=1292; TER/OMB, N=677; For alle sammenslåtte analyser ble en fast verdi på LLN (ved bruk av ALITHIOS-studiereferanse) brukt: IgG: 5,65 g/L; R1: Den første pasienten med første behandlingsvurdering i OMB-perioden etter bytte til OMB (72 uker); R2: Den siste pasienten med siste behandlingsoppståtte vurdering i TER-perioden før bytte til OMB (120 uker); a, Bytteperiode refererer til pasienter som startet med teriflunomid og ikke aktuelt for pasienter med ofatumumab i kjerneperioden; for TER/OMB-gruppedata fra 1. dose av TER til siste dose av OMB pluss 100 dager/analyser er det brukt cut-off dato. Ig, immunoglobulin; LLN, nedre normalgrense; SE, standardfeil; TER/OMB, byttet fra teriflunomid til ofatumumab.
Risikoen for maligniteter var lav (Tabell 5). Malignitetsbivirkninger ble rapportert hos 11 pasienter (0,3%) i hele sikkerhetspopulasjonen, med EAIRs (95 % KI) på 0,3 (0,1 – 0,5).
Tabell 5: Maligniteter. Tabell utarbeidet av Novartis basert på Hauser et al.2
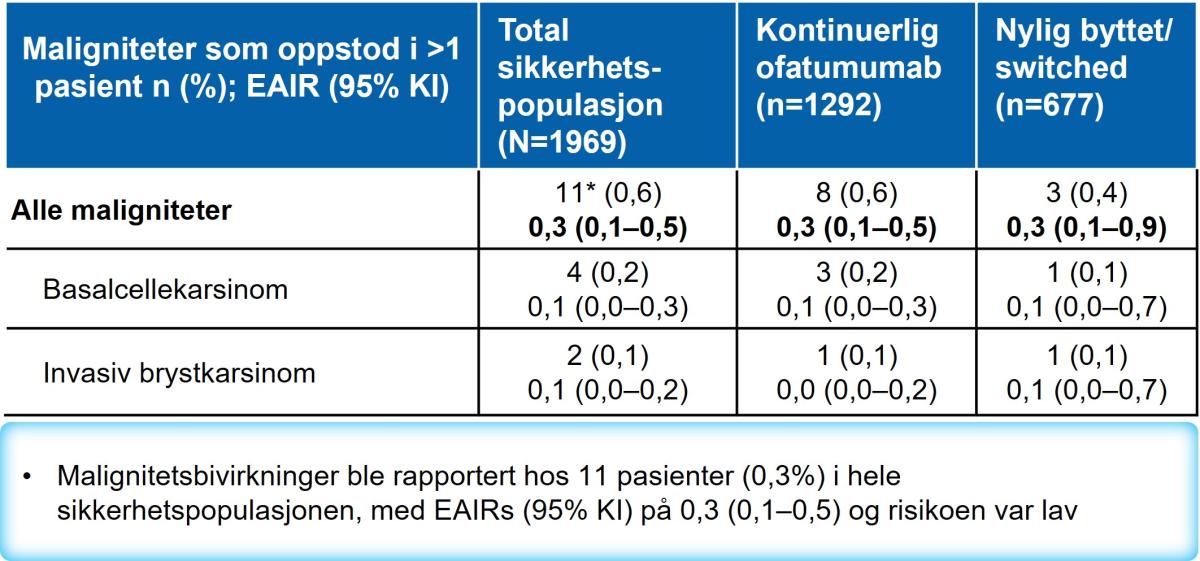
EAIR, exposure adjusted incidence rate; OMB, ofatumumab. *inkluderer 5 maligniteter tidligere rapportert i kjernestudien i OMB-armen
Hos RMS pasienter med opptil 3,5 år med eksponering, så var 20 mg månedlig dosering med ofatumumab godt tolerert, uten nye identifiserte sikkerhetsrisikoer.2
Disse funnene, sammen med effektdata fra fase 3-studiene ASCLEPIOS I og II, støtter en gunstig nytte-risiko-profil for ofatumumab hos personer med relapserende MS.
