Direktoratet for medisinske produkter: Bivirkninger og legemiddelsikkerhet - DMP. legemiddelverket.no/bivirkninger-og-sikkerhet/
▼Dette legemidlet er underlagt særlig overvåking for å oppdage ny sikkerhetsinformasjon så raskt som mulig. Helsepersonell oppfordres til å melde enhver mistenkt bivirkning. Melding av mistenkte bivirkninger etter godkjenning av legemidlet er viktig. Novartis jobber kontinuerlig med å overvåke sikkerheten til produktene våre. Bivirkningsrapporter og produktklager er et viktig bidrag til nytte/risiko evalueringen som gjøres fortløpende for hvert produkt. Informasjonen blir utvekslet med myndigheter i tråd med gjeldende regelverk.
Bivirkninger kan meldes direkte til Statens Legemiddelverk: Direktoratet for medisinske produkter: Bivirkninger og legemiddelsikkerhet - DMP. Du kan også melde bivirkninger og produktklager direkte til Novartis ved å fylle ut skjemaet på denne siden: https://www.novartis.com/no-no/om-oss/kontakt-oss
Andelen bivirkninger var balansert mellom ofatumumab og teriflunomid i begge fase 3-studiene, ASCLEPIOS I og II (tabell 1). De hyppigst rapporterte birvirkningene (≥5 % i en av behandlingsgruppene) var injeksjonsrelaterte reaksjoner, nasofaryngitt, hodepine og lokale injeksjonsreaksjoner. Den samlede forekomsten av infeksjoner og alvorlige infeksjoner hos pasienter behandlet med Kesimpta® var tilsvarende som hos pasienter behandlet med teriflunomid (henholdsvis 51,6 % vs. 52,7 % og 2,5 % vs. 1,8 %).1 Hos pasienter som rapporterte systemiske injeksjonsrelaterte reaksjoner, så var 99 % milde til moderate i alvorlighet. Forskjellen i systemiske reaksjoner med ofatumumab sammenlignet med sham intervensjon (placebo), var begrenset til første injeksjon.
Tabell 1: Sikkerhetsparametre fra de to pivotale fase 3-studiene ASCLEPIOS I og II.1* Tabell utarbeidet av Novartis basert på Hauser et al.1
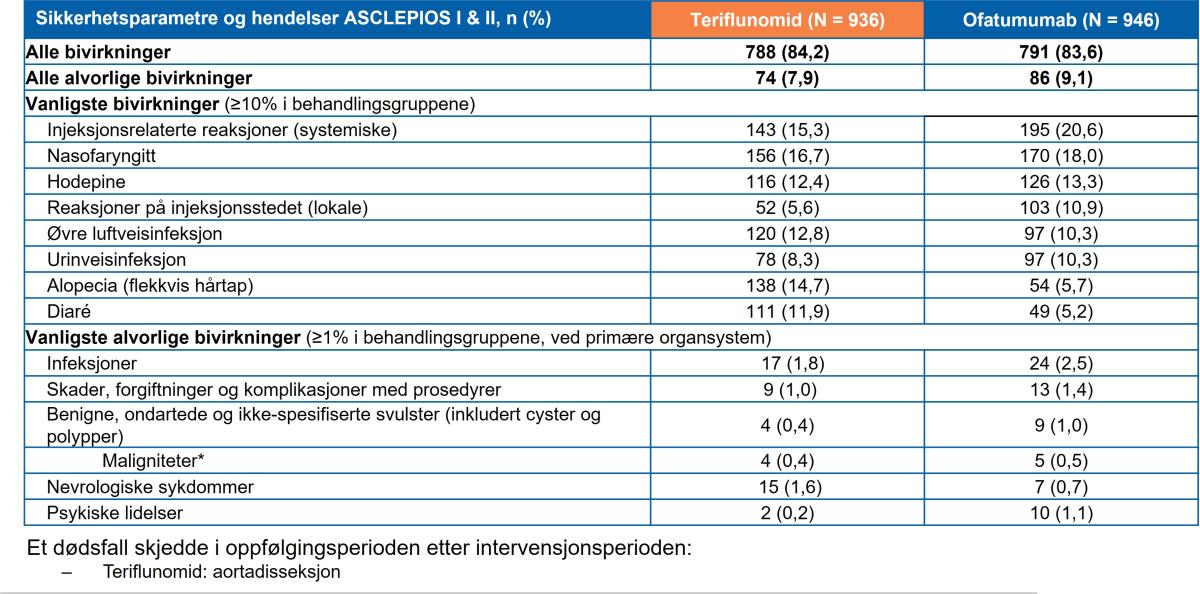
*Merk: Tabelloversikten over vil avvike noe fra sikkerhetsparameterne oppgitt i preparatomtalen (SmPC) for Kesimpta®.2
Tabell 2: Bivirkningstabell. Bivirkninger som har vært rapportert i forbindelse med bruk av ofatumumab i pivotale kliniske studier ved RMS og etter markedsføring.2

Bivirkninger som har vært rapportert i forbindelse med bruk av ofatumumab i pivotale kliniske studier ved RMS og etter markedsføring, er oppgitt i tabell 2 i henhold til MedDRAs organklassesystem. Innen hver organklasse er bivirkninger rangert etter frekvens, med de hyppigst forekommende reaksjonene først. Innen hver frekvensgruppering er bivirkninger presentert etter synkende alvorlighetsgrad. I tillegg er de tilsvarende frekvenskategoriene for hver bivirkning basert på følgende inndeling: svært vanlige (≥ 1/10), vanlige (≥ 1/100 til < 1/10), mindre vanlige (≥ 1/1 000 til < 1/100), sjeldne (≥ 1/10 000 til < 1/1 000), svært sjeldne (< 1/10 000), ikke kjent (kan ikke anslås ut ifra tilgjengelige data).
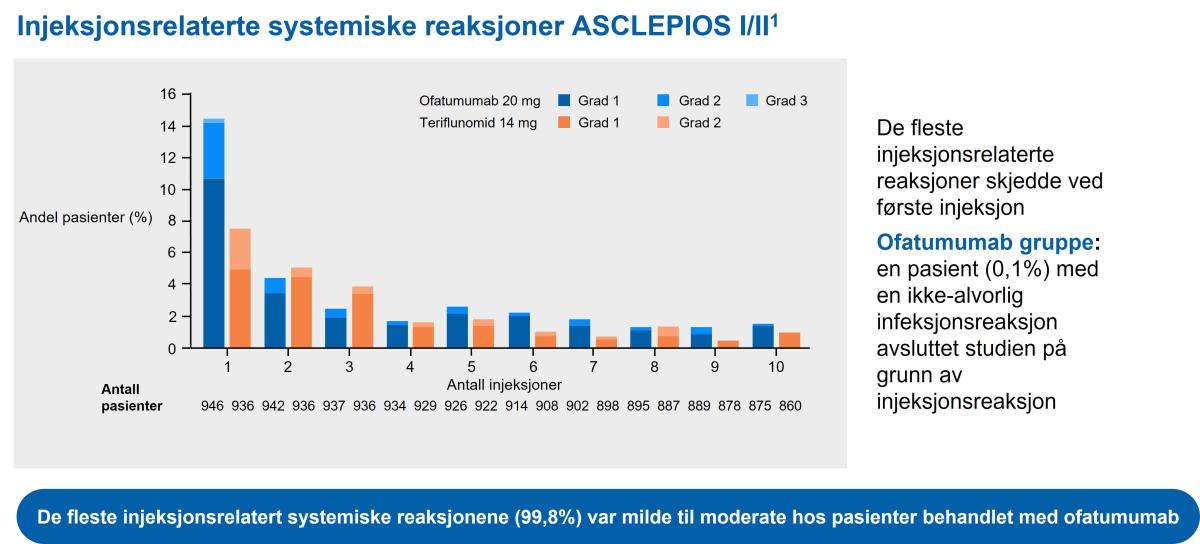
Figur 1: Injeksjonsrelaterte systemiske reaksjoner. De fleste injeksjonsrelatert systemiske reaksjonene (98,8 %) var milde til moderate hos pasienter behandlet med ofatumumab. De fleste injeksjonsrelaterte reaksjoner skjedde ved første injeksjon.1,2 Figur utarbeidet av Novartis basert på Hauser et al.1
Antistoff mot legemiddel (Anti-Drug Antibodies, [ADA]) ble vurdert ved baseline, ved måned 1, 6, 12 og 24, og ved studieslutt (end of study [EOS]) for å evaluere immunogenisitetspotensialet til ofatumumab. Antistoff-binding mot legemiddelet utviklet seg hos 2 av 946 pasienter (0,2 %) som fikk ofatumumab i begge studiene (ASCLEPIOS I/II). Ingen pasienter i studiene utviklet nøytraliserende antistoffer ([Nabs]).3
I løpet av de kliniske fase III-studiene ASCLEPIOS I/II ved RMS ble det observert en reduksjon i gjennomsnittlig verdi for immunglobulin M (IgM) (30,9 % reduksjon etter 48 uker og 38,8 % reduksjon etter 96 uker), og det ble ikke vist en assosiasjon med risiko for infeksjoner, inkludert alvorlige infeksjoner. Hos 14,3 % av pasientene resulterte behandling med ofatumumab i en reduksjon i IgM til en verdi på under 0,34 g/l. Ofatumumab var forbundet med en forbigående reduksjon i gjennomsnittlig nivå av immunglobulin G (IgG) på 4,3 % etter 48 ukers behandling, men en økning på 2,2 % etter 96 uker (SmPC pkt 4.8).2
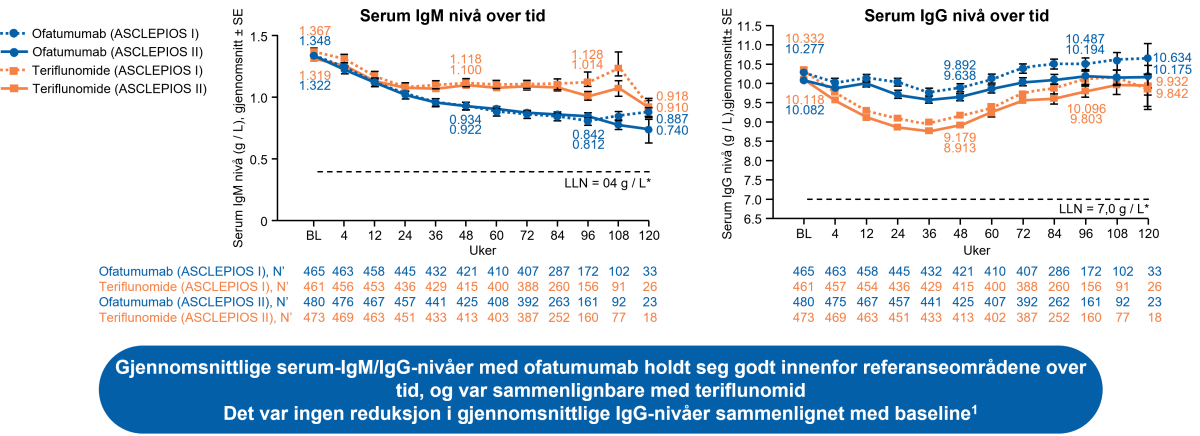
Figur 2: Gjennomsnittlig IgG / IgM nivå holdt seg innen referanseområdene med ofatumumab i ASCLEPIOS I/II.1 Figur utarbeidet av Novartis basert på Hauser et al.1

