ASCLEPIOS I og II (NCT02792218 and NCT02792231) er to identisk designet, dobbeltblindet, dobbel-dummy, randomiserte, fleksibel varighet (opptil 30 måneder), parallellgruppe, aktiv-komparator, multisenter fase 3-studier (ASCLEPIOS I og II).1,2,3
Hensikten med studiene var å evaluere sikkerheten og effekten av Kesimpta® 20mg månedlig subkutan injeksjoner mot teriflunomide (Aubagio®) 14mg tablett en gang om dagen hos voksne med bekreftet diagnose av relapserende multippel sklerose (RMS) (Figur 1).1 Pasientene ble randomisert til to dobbelt-dummy subkutan injeksjon med Kesimpta® (20mg hver fjerde uke) eller oral teriflunomid (14mg daglig) opptil 30 måneder. Pasientene fikk også matchende placebo som tilsvarte den andre behandlingsarmen for å sikre blinding (double-dummy-design).1,4
Fase 3 ASCLEPIOS I og II studiene var to identisk designet, dobbeltblindete, dobbel-dummy, aktiv-komparator, parallellgruppe, multisenter, adaptive designet med fleksibel varighet (maksimal varighet opp til 30 måneder), se figur 1.
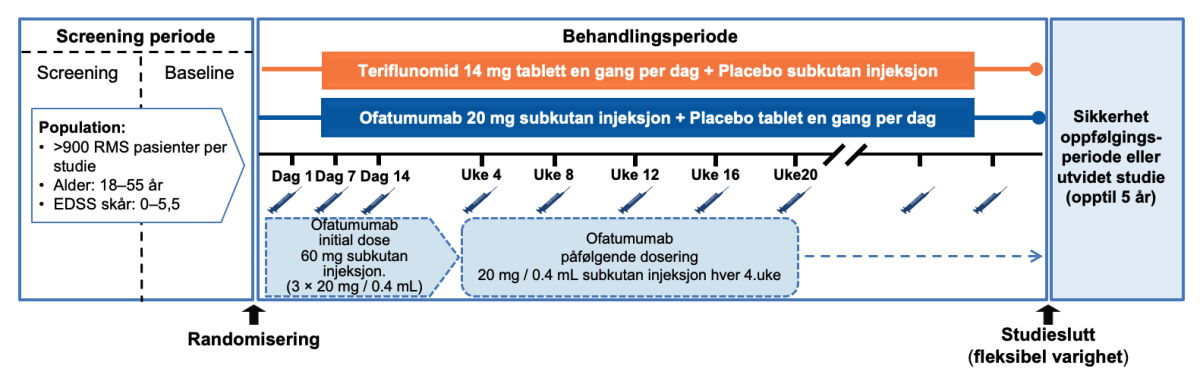
Figur 1: Studiedesign av fase 3 ASCLEPIOS I & II studiene. Pasientene ble randomisert til dobbelt-dummy subkutan ofatumumab (20mg hver 4.uke) eller oral teriflunomid (14mg daglig) opptil 30 måneder. Pasientene mottok 20mg ofatumumab subkutane injeksjoner på dag 1, 7 og 14 (initial dosering), og hver fjerde uke fra uke 4 (påfølgende dosering). Figur utarbeidet av Novartis basert på Hauser et al.1
Referanser
1. Hauser SL, Bar-Or A, Cohen JA, et al.; ASCLEPIOS I and ASCLEPIOS II Trial Groups. Ofatumumab versus Teriflunomide in Multiple Sclerosis. N Engl J Med. 2020 Aug 6;383(6):546-557. doi: 10.1056/NEJMoa1917246.
2. ClinicalTrials.gov Identifier: NCT02792218 (ASCLEPIOS I). . Tilgjengelig fra: https://clinicaltrials.gov/ct2/show/NCT02792231
3. ClinicalTrials.gov Identifier: NCT02792231 (ASCLEPIOS II). . Tilgjengelig fra: https://clinicaltrials.gov/ct2/show/NCT02792231
4. Direktoratet for medisinske produkter. Kesimpta® (ofatumumab) – preparatomtale (SmPC) [Internett]. Oslo: Direktoratet for medisinske produkter Tilgjengelig fra: https://www.legemiddelsok.no/sider/Legemiddelvisning.aspx?pakningId=4a4e4994-df65-4fd0-ac38-40d47d350fa3&searchquery=ofatumumab&f=Han;MtI;Vir;ATC;Var;Mar;Mid;Avr;gen;par;&pane=0
Det primære endepunktet på begge studiene var å demonstrere at Kesimpta® er bedre enn teriflunomid i å redusere frekvensen av bekreftete attakker, vurdert som årlig attakkrate [annualized relapse rates (ARR)] hos pasienter behandlet opptil 30 måneder.
Viktige MR endepunkt var gadoliniumforsterkende (Gd+1) lesjoner og årlig rate av nye eller forstørrede T2 lesjoner. Et viktig klinisk endepunkt var reduksjon av risiko for 3 måneders bekreftet sykdomsprogresjon (3 m CDP). Behandlingsvarighet varierte basert på kriteriene for å avslutte studien. Maksimal varighet var 120 uker, median varighet var 85 uker.1
Sikkerhet og farmakokinetiske egenskaper av Kesimpta® ble også målt gjennom hele behandlingsperioden.2,3
Referanser
1. Hauser SL, Bar-Or A, Cohen JA, et al.; ASCLEPIOS I and ASCLEPIOS II Trial Groups. Ofatumumab versus Teriflunomide in Multiple Sclerosis. N Engl J Med. 2020 Aug 6;383(6):546-557. doi: 10.1056/NEJMoa1917246.
2. ClinicalTrials.gov Identifier: NCT02792218 (ASCLEPIOS I). . Tilgjengelig fra: https://clinicaltrials.gov/ct2/show/NCT02792218
3. ClinicalTrials.gov Identifier: NCT02792231 (ASCLEPIOS II). . Tilgjengelig fra: https://clinicaltrials.gov/ct2/show/NCT02792231
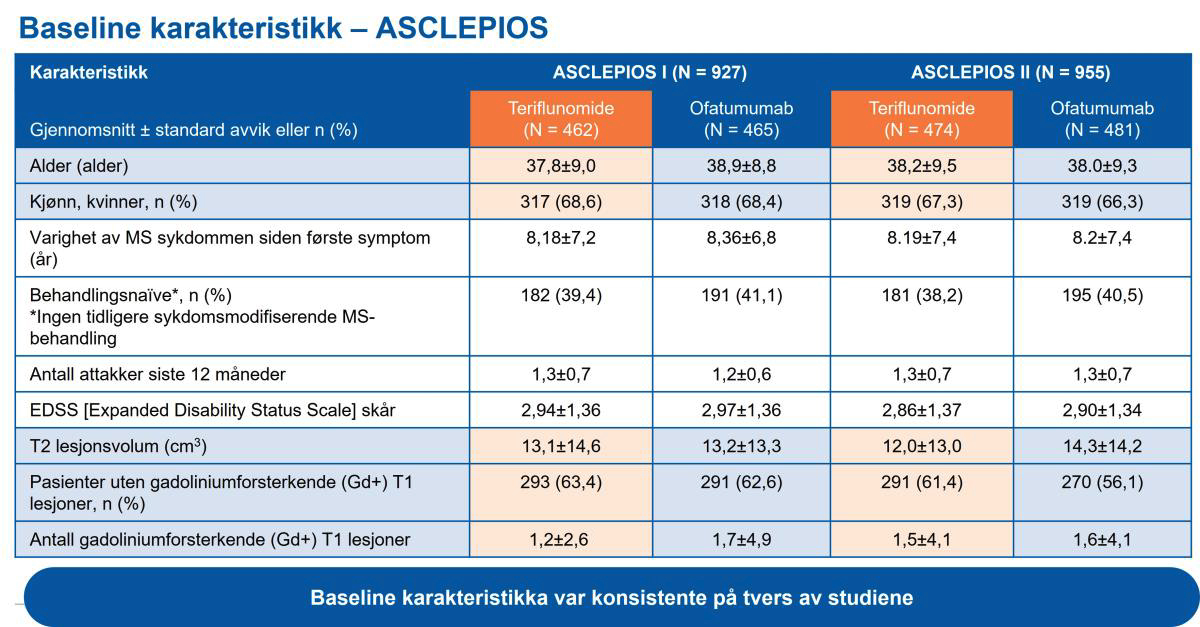
Begge ASCLEPIOS-studiene1 randomiserte 1882 pasienter (ASCLEPIOS I, N=927; ASCLEPIOS II, N=955) med relapserende multippel sklerose (RMS) på mellom 18 og 55 år (EDSS: 0 til 5,5) (tabell 1). Median oppfølgingstid i begge studiene var på 1,6 år. Omtrent 40 % av pasientene var behandlingsnaive. Pasientene i begge studiene var i snitt 38 år og gjennomsnittlig tid med MS siden første symptom var ca. 8 år. Gjennomsnittlig EDSS var 2,9. I begge studiene var de fleste pasientene i stand til selv å administerere Kesimpta® alene hjemme etter at de første dosene ble administrert under oppsyn av helsepersonell. Etter fjerde injeksjon, så administrerte i snitt 74,4 % av pasientene Kesimpta® hjemme i ASCLEPIOS I og II-studiene.
Tabell 1: Baseline karakteristika i ASCLEPIOS I & II. Tabell utarbeidet av Novartis basert på Hauser et al.1
Referanser
1. Hauser SL, Bar-Or A, Cohen JA, et al.; ASCLEPIOS I and ASCLEPIOS II Trial Groups. Ofatumumab versus Teriflunomide in Multiple Sclerosis. N Engl J Med. 2020 Aug 6;383(6):546-557. doi: 10.1056/NEJMoa1917246.
ASCLEPIOS I & II studiene undersøkte effekten av ofatumumab (Kesimpta®) mot teriflunomid (Aubagio®): Endepunktene i studien: Årlig attakkrate (primære endepunkt) - MR endepunkter - Bekreftet sykdomsforverring etter 3 og 6 måneder - Neurofilament light chain (NfL)
Attakker har en betydelig negativ innvirkning på pasientenes daglige aktiviteter og liv.1 Hyppige attakker tidlig i sykdomsforløpet er assosiert med langvarig sykdomsprogresjon.2
Resultatene demonstrerte at Kesimpta® hadde en reduksjon på årlig attakkrate på 50,5 % i ASCLEPIOS I og 58,5 % i ASCLEPIOS II, sammenlignet med teriflunomid behandlete pasienter (Figur 2).
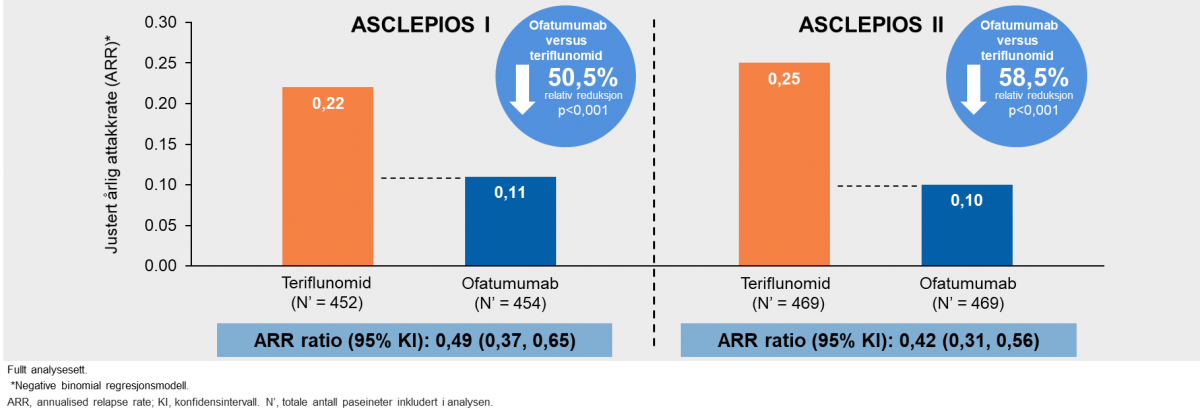
Figur 2: Kesimpta® demonstrerte en signifikant reduksjon i årlig attakkrate (ARR) versus teriflunomid (primære endepunkt). Figur utarbeidet av Novartis basert på Hauser et al.3
Referanser
1. Nickerson M, Cofield SS, Tyry T, Salter AR, Cutter GR, Marrie RA. Impact of multiple sclerosis relapse: The NARCOMS participant perspective. Mult Scler Relat Disord. 2015 May;4(3):234-40. doi: 10.1016/j.msard.2015.03.005.
2. Scalfari A, Neuhaus A, Degenhardt A, Rice GP, Muraro PA, Daumer M, Ebers GC. The natural history of multiple sclerosis: a geographically based study 10: relapses and long-term disability. Brain. 2010 Jul;133(Pt 7):1914-29. doi: 10.1093/brain/awq118.
3. Hauser SL, Bar-Or A, Cohen JA, Comi G, et al.; ASCLEPIOS I and ASCLEPIOS II Trial Groups. Ofatumumab versus Teriflunomide in Multiple Sclerosis. N Engl J Med. 2020 Aug 6;383(6):546-557. doi: 10.1056/NEJMoa1917246.
Kesimpta® viste også signifikant reduksjon i antall gadolinium gadoliniumforsterkende T1 vektede lesjoner med 98% reduksjon i ASCLEPIOS I og 94 % reduksjon i ASCLEPIOS II (Figur 3).
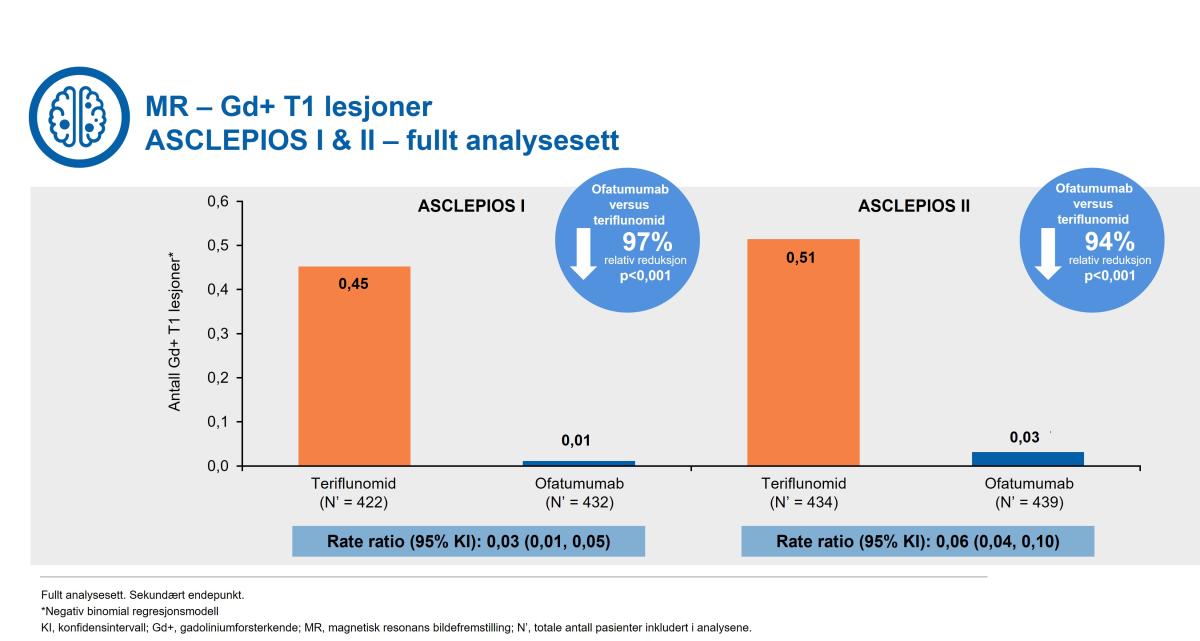
Figur 3: Kesimpta® demonstrerte en signifikant reduksjon i antall gadoliniumforsterkende T1-lesjoner (Gd+) versus teriflunomid. Figur utarbeidet av Novartis basert på Hauser et al.1
Kesimpta® reduserte nye eller forstørrede T2 lesjoner med 82 % i ASCLEPIOS I og 85 % i ASCLEPIOS II (figur 4).
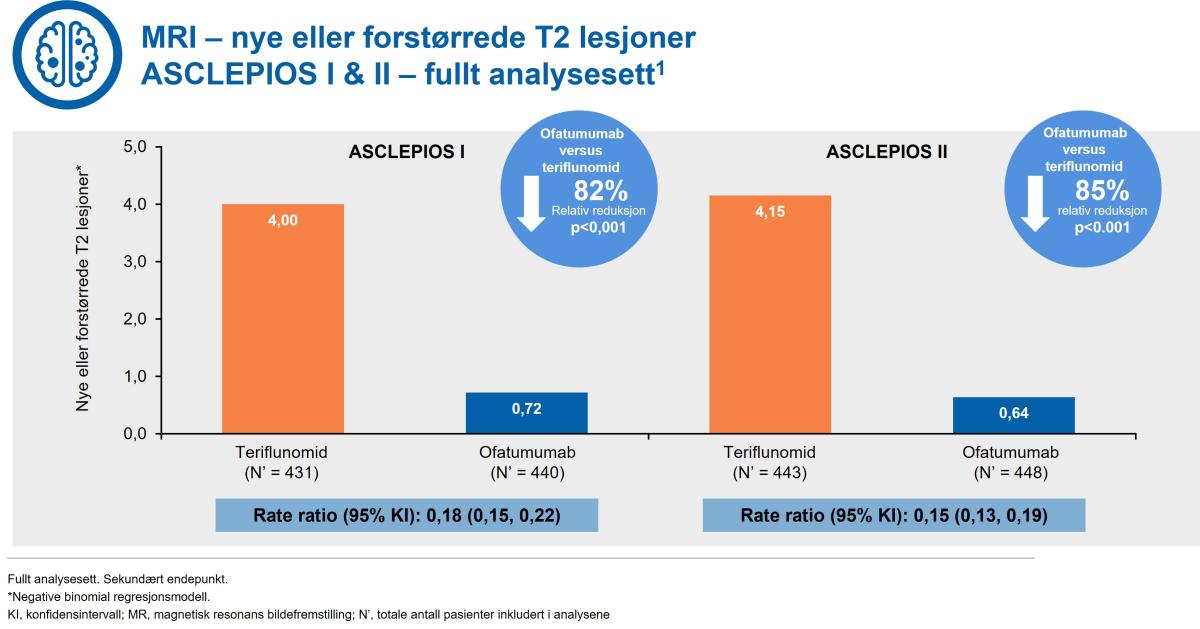
Figur 4: Kesimpta® demonstrerte en signifikant reduksjon i nye eller forstørrede T2-lesjoner versus teriflunomid. Figur utarbeidet av Novartis basert på Hauser et al.1
Referanser
1. Hauser SL, Bar-Or A, Cohen JA, et al.; ASCLEPIOS I and ASCLEPIOS II Trial Groups. Ofatumumab versus Teriflunomide in Multiple Sclerosis. N Engl J Med. 2020 Aug 6;383(6):546-557. doi: 10.1056/NEJMoa1917246
Det var ingen forskjell i tap av hjernevolum fra baseline mellom de to aktive behandlingene Kesimpta® og teriflunomid (figur 5).1
Tidligere har tap av hjernevolum (hjerneatrofi) blitt sett på som et tegn på langt fremskredet MS-sykdom, men har i senere tid vist at inntreffer allerede fra tidlig stadium av MS-sykdommen. Det er funnet sammenheng mellom hjerneatrofi og graden av symptomer ved MS.2
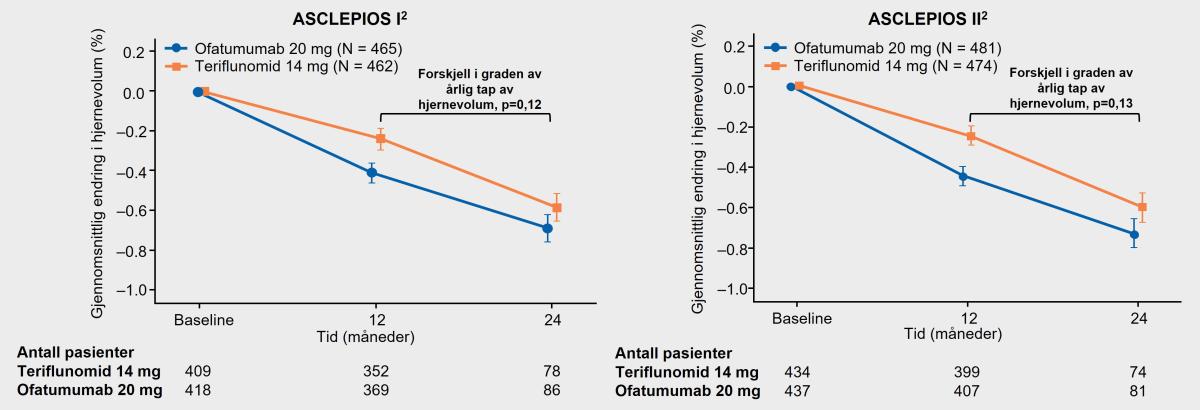
Figur 5: Det var ingen signifikant endring i graden av hjernevolumatrofi mellom behandlingsgruppene. Det var en generelt lav årlig forandring av hjernevolumstap i begge behandlingsgruppene; en lignende effekt på endring i hjernevolum ble observert med ofatumumab versus teriflunomid. Estimering av kurver basert på helningen fra en tilfeldig koeffisientmodell. Komplett analysesett. Sekundært endepunkt. Figur utarbeidet av Novartis basert på Hauser et al.1
Referanser:
1. Hauser SL, Bar-Or A, Cohen JA, et al.; ASCLEPIOS I and ASCLEPIOS II Trial Groups. Ofatumumab versus Teriflunomide in Multiple Sclerosis. N Engl J Med. 2020 Aug 6;383(6):546-557. doi: 10.1056/NEJMoa1917246.
2. University of California, San Francisco MS-EPIC Team, Cree BAC, Hollenbach JA, Bove R, et al. Silent progression in disease activity-free relapsing multiple sclerosis. Ann Neurol. 2019 May;85(5):653-666. doi: 10.1002/ana.25463.
Resultatene viste en relativ risikoreduksjon på mer enn 30 % på 3 og 6 måneders bekreftet sykdomsforverring sammenlignet med teriflunomid (Figur 6). Forsinket progresjon kan øke tiden pasienter er i stand til å fortsette å delta i arbeidslivet og klare seg selv.1
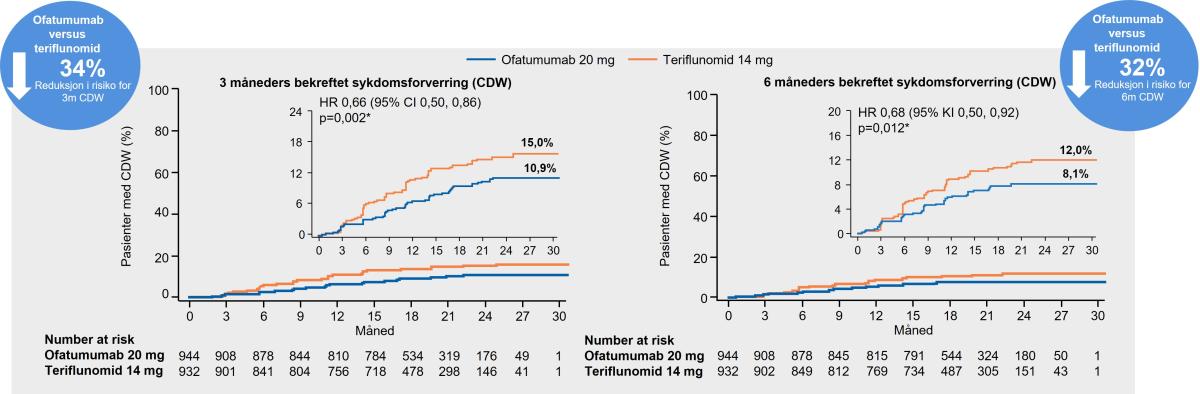
Figur 6: Kesimpta® demonstrerte en signifikant reduksjon i tre- og seksmåneders bekreftet sykdomsprogresjon [Confirmed Disability Worsening (CDW)]. Dataene er fra forhåndsspesifisert samlet analyse fra begge studiene. Figur utarbeidet av Novartis basert på Hauser et al.2
Referanser:
1. Kobelt G, Thompson A, Berg J, Gannedahl M, Eriksson J; MSCOI Study Group; European Multiple Sclerosis Platform. New insights into the burden and costs of multiple sclerosis in Europe. Mult Scler. 2017 Jul;23(8):1123-1136. doi: 10.1177/1352458517694432.
2. Hauser SL, Bar-Or A, Cohen JA, et al.; ASCLEPIOS I and ASCLEPIOS II Trial Groups. Ofatumumab versus Teriflunomide in Multiple Sclerosis. N Engl J Med. 2020 Aug 6;383(6):546-557. doi: 10.1056/NEJMoa1917246.
Nevrofilamenter er en biomarkør for nevroaksonal skade, som starter ved sykdomsdebut og er en konsekvens av betennelse i sentralnervesystemet.1
Ved første måling ved 3. til og med 24. måned så var det en signifikant og konsistent reduksjon i serum nevrofilament (NfL) nivå for ofatumumab-behandlede pasienter sammenlignet med teriflunomid-behandlede pasienter (figur 7).2
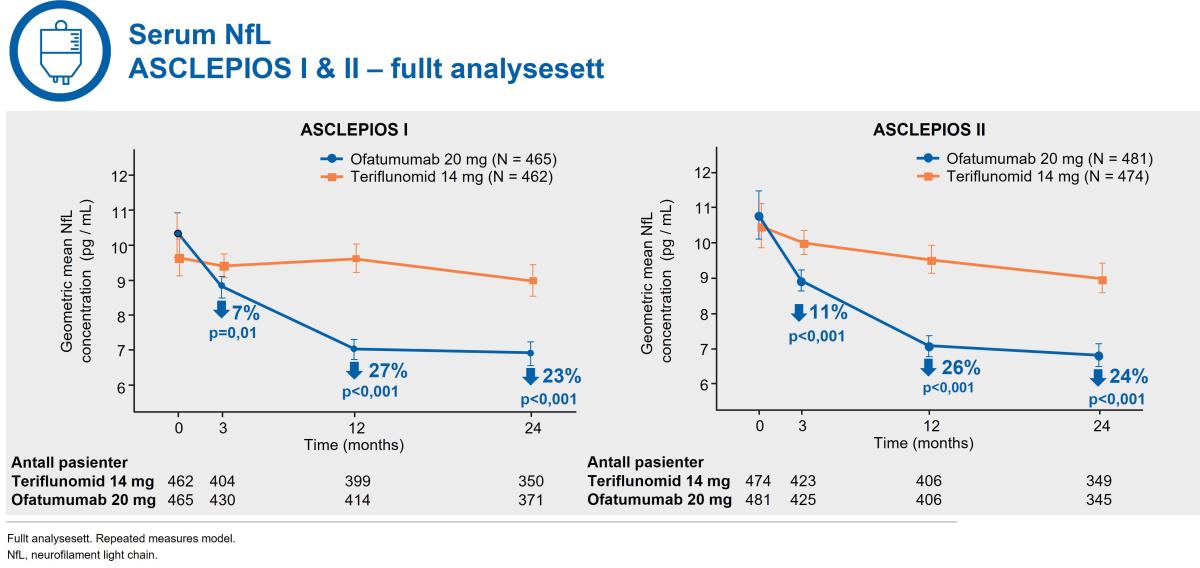
Figur 7: Kesimpta® demonstrerte en signifikant, tidlig og konsistent reduksjon i serum nevrofilament fra første måling ved 3. måned. Figur utarbeidet av Novartis basert på Hauser et al.2
Referanser
1. Disanto G, Barro C, Benkert P, Naegelin Y, Schädelin S, Giardiello A, Zecca C, Blennow K, Zetterberg H, Leppert D, Kappos L, Gobbi C, Kuhle J; Swiss Multiple Sclerosis Cohort Study Group. Serum Neurofilament light: A biomarker of neuronal damage in multiple sclerosis. Ann Neurol. 2017 Jun;81(6):857-870. doi: 10.1002/ana.24954.
2. Hauser SL, Bar-Or A, Cohen JA, Comi G, Correale J, Coyle PK, Cross AH, de Seze J, Leppert D, Montalban X, Selmaj K, Wiendl H, Kerloeguen C, Willi R, Li B, Kakarieka A, Tomic D, Goodyear A, Pingili R, Häring DA, Ramanathan K, Merschhemke M, Kappos L; ASCLEPIOS I and ASCLEPIOS II Trial Groups. Ofatumumab versus Teriflunomide in Multiple Sclerosis. N Engl J Med. 2020 Aug 6;383(6):546-557. doi: 10.1056/NEJMoa1917246.
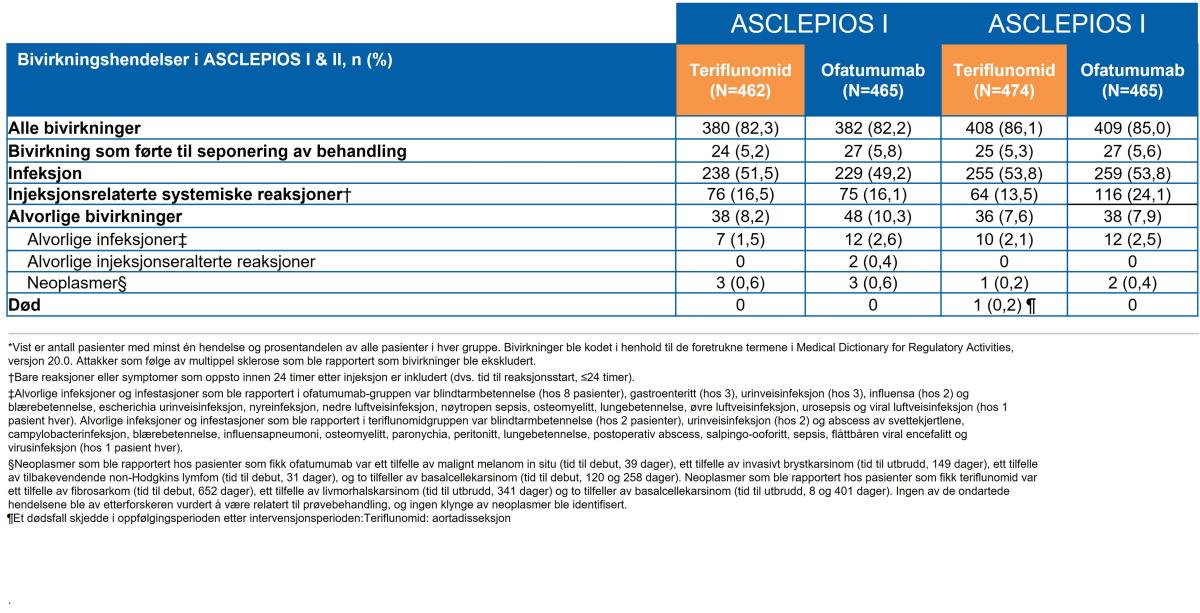
Andelen bivirkninger var balansert mellom Kesimpta® (ofatumumab) og teriflunomid i begge fase 3-studiene, ASCLEPIOS I og II (Tabell 2). De hyppigst rapporterte birvirkningene (≥5 % i en av behandlingsgruppene) var injeksjonsrelaterte reaksjoner, nasofaryngitt, hodepine og lokale injeksjonsreaksjoner (Tabell 2). Den samlede raten av infeksjoner hos pasienter behandlet med Kesimpta® versus teriflunomid var 51,6 % versus 52,7 %, og for alvorlige infeksjoner var den 2,5 % versus 1,8 %.
Hos pasienter som rapporterte systemiske injeksjonsrelaterte reaksjoner, så var 99% milde til moderate i alvorlighet. Forskjellen i systemiske reaksjoner med ofatumumab sammenlignet med sham intervensjon (placebo), var begrenset til første injeksjon (Figur 8).1,2
Insidensen av systemiske injeksjonsrelaterte reaksjoner var høyest ved første injeksjon (14,4 %) og sank signifikant ved påfølgende injeksjoner (4,4 % ved den andre, < 3 % fra tredje injeksjon). Injeksjonsrelaterte reaksjoner var for det meste (99,8 %) milde til moderate. De hyppigst rapporterte symptomene (≥ 2 %) omfattet feber, hodepine, myalgi, frysninger og fatigue.1,2
Lokale reaksjoner på administrasjonsstedet var svært vanlige. Alle reaksjoner på injeksjonsstedet var milde til moderate og ikke-alvorlige av natur. De hyppigst rapporterte symptomene (≥ 2 %) omfattet erytem, smerte, kløe og hevelse.1,2
Andelen som seponerte behandlingen på grunn av bivirkninger var lik mellom pasientene som fikk Kesimpta (5,8 %) og teriflunomid (5,2 %).1,2
Tabell 2: Bivirkningshendelser (sikkerhetspopulasjon*). Tabell utarbeidet av Novartis etter Hauser et al.1
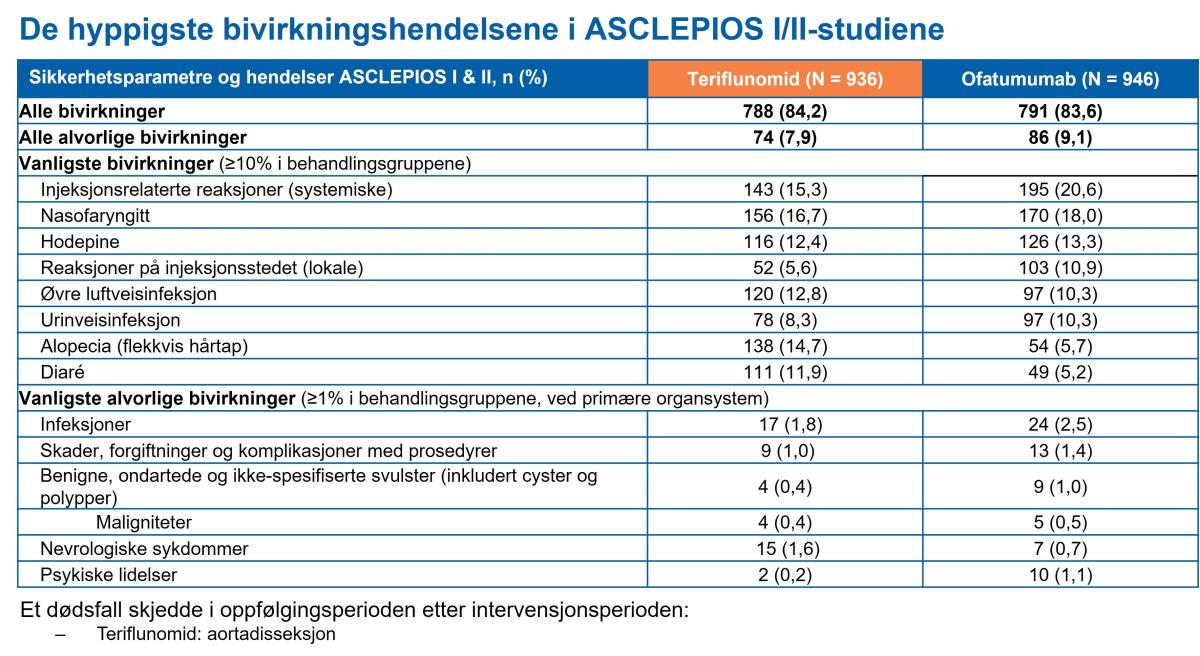
Tabell 3: De hyppigste bivirkningene i ASCLEPIOS I & II-studiene. Tabell utarbeidet av Novartis etter Hauser et al.1
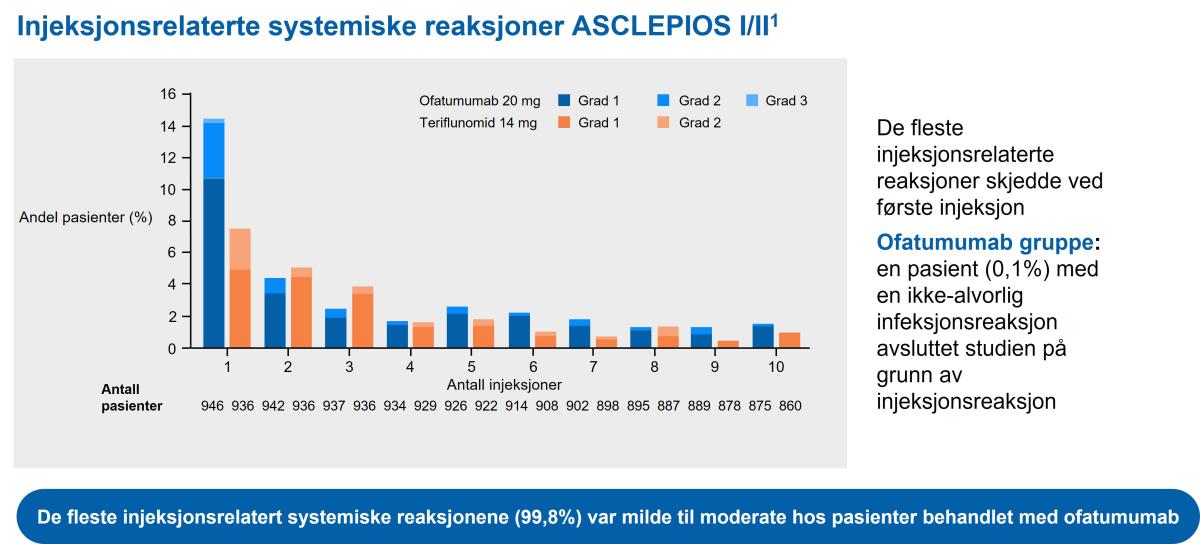
Figur 8: Injeksjonselaterte systemiske reaksjoner i ASCLEPIOS I og II studiene. Figur utarbeidet av Novartis etter Hauser et al.1
I løpet av de kliniske fase III-studiene ved RMS ble det observert en reduksjon i gjennomsnittlig verdi for immunglobulin M (IgM) (30,9 % reduksjon etter 48 uker og 38,8 % reduksjon etter 96 uker), og det ble ikke vist en assosiasjon med risiko for infeksjoner, inkludert alvorlige infeksjoner. Hos 14,3 % av pasientene resulterte behandling med ofatumumab i en reduksjon i IgM til en verdi på under 0,34 g/l. Ofatumumab var forbundet med en forbigående reduksjon i gjennomsnittlig nivå av immunglobulin G (IgG) på 4,3 % etter 48 ukers behandling, men en økning på 2,2 % etter 96 uker (se figur 9).2
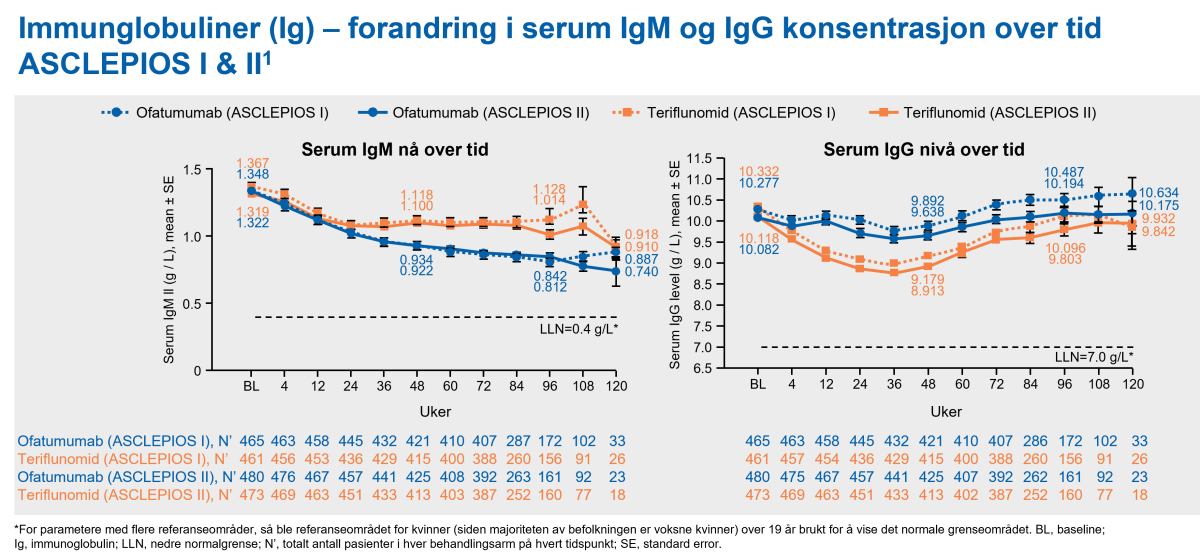
Figur 9: Immunglobulin M (IgM) og immunglobulin G (IgG) konsentrasjoner over tid. Gjennomsnittlige serum-IgM/IgG-nivåer holdt seg godt innenfor referanseområdene over tid, og det var ingen reduksjon i gjennomsnittlige IgG-nivåer sammenlignet med baseline. Det var ingen tilsynelatende sammenheng mellom reduserte Ig-nivåer med økt risiko for infeksjoner hos pasienter som fikk ofatumumab.3 Figur utarbeidet av Novartis.1,2
Avslutting av behandling i ASCLEPIOS I/II grunnet lave IgM eller IgG var generelt ikke pga infeksjoner, men heller på grunn av forhåndsdefinert grenseverdi per studieprotokoll. Terskel for avslutting av behandling var 10% under nedre referanseverdi for IgM og 20% under nedre referanseverdi for IgG. Gjennopptakelse i studien ble kun vurdert når Ig nivåene var tilbake til normale verdier. Totalt så krevde 42 pasienter midlertidig behandlingsavbrudd pga lave IgM (10% < nedre referanseverdi), og 2 pasienter krevde midlertidig avbrudd pga lave IgG (20% < nedre referanseverdi). To pasienter avsluttet behandlingen pga lave IgG. Totalt 19 pasienter avsluttet behandlingen pga lave IgM (se tabell under). Ingen pasienter hadde IgG 50% under referanseverdi (hypoglammaglobulinemi) i hverken ofatumumab eller teriflunomid-behandlingsgruppene.3
Etterlevelse (compliance)
Det var god etterlevelse blant pasientene i ASCLEPIOS I/II fase 3 studiene1
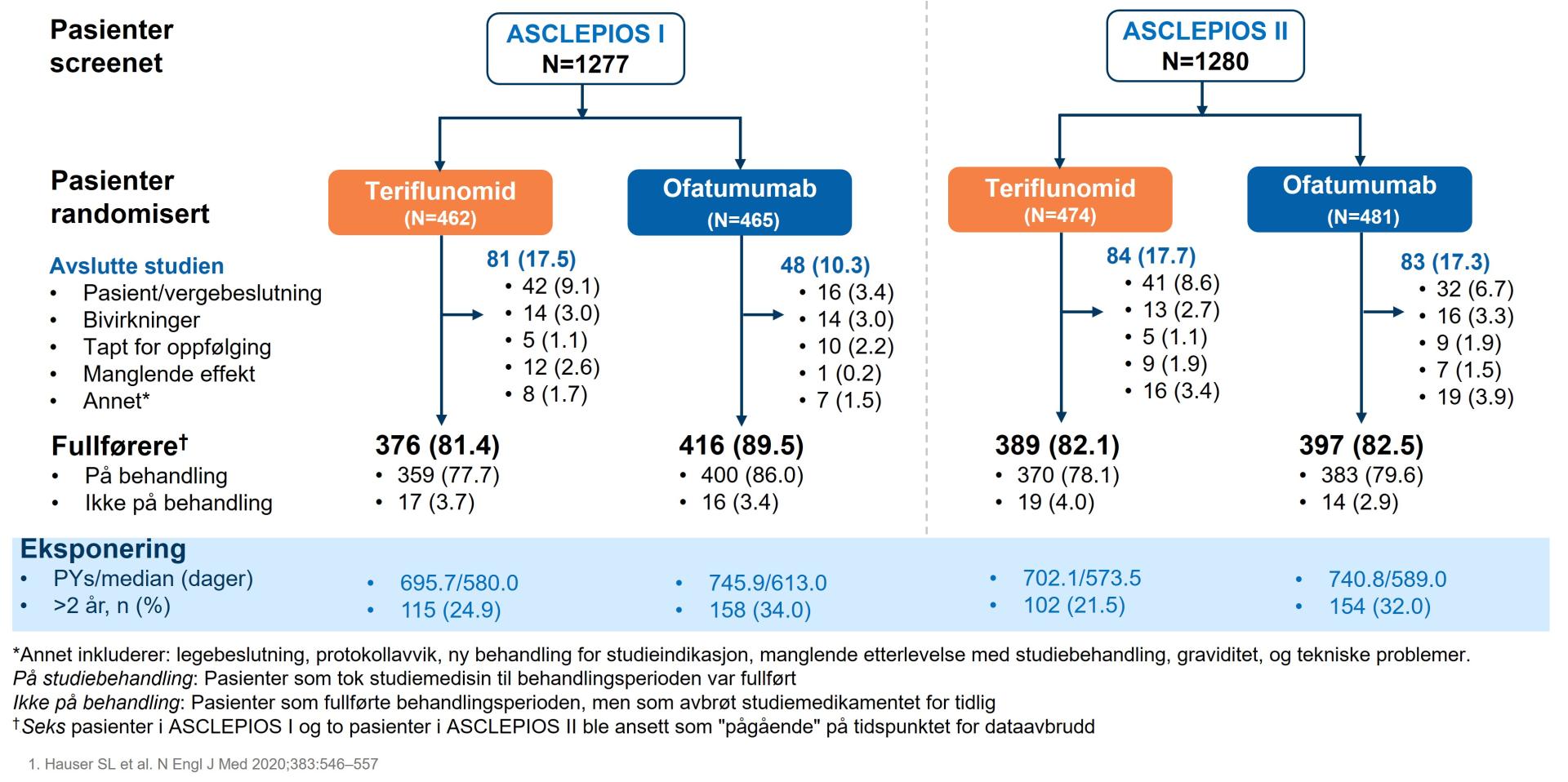
Compliance til ofatumumab-behandling i ASCLEPIOS I/II ble vurdert som eksponering til studiemedikament [dager]/under-behandlingsperiode [dager]×100 %. I begge ASCLEPIOS studiene, så hadde >95% av pasientene ≥90% compliance med behandlingene på tvers av behandlingsgruppene. Flere ofatumumab-behandlete pasienter fullførte studien i ASCLEPIOS I (89,5%) sammenlignet med teriflunomid-behandlete pasienter (81,4%). I ASCLEPIOS II fullførte 82,5% i ofatumumab-behandlingsgruppen versus 82,1% i teriflunomid-behandlingsgruppen (se figur 10).1
Figur 10: Pasientflyt ASCLEPIOS I & II. Figur utarbeidet av Novartis basert på Hauser et al.1
Referanser
1. Hauser SL, Bar-Or A, Cohen JA, et al.; ASCLEPIOS I and ASCLEPIOS II Trial Groups. Ofatumumab versus Teriflunomide in Multiple Sclerosis. N Engl J Med. 2020 Aug 6;383(6):546-557. doi: 10.1056/NEJMoa1917246.
2. Direktoratet for medisinske produkter. Kesimpta® (ofatumumab) – preparatomtale (SmPC) [Internett]. Oslo: Direktoratet for medisinske produkter Tilgjengelig fra: https://www.legemiddelsok.no/sider/Legemiddelvisning.aspx?pakningId=4a4e4994-df65-4fd0-ac38-40d47d350fa3&searchquery=ofatumumab&f=Han;MtI;Vir;ATC;Var;Mar;Mid;Avr;gen;par;&pane=0
3. Supplement to: Hauser SL, Bar-Or A, Cohen JA, et al. Ofatumumab versus teriflunomide in multiple sclerosis. N Engl J Med 2020;383:546-57. doi: 10.1056/NEJMoa1917246
Bakgrunn:
Effekten og sikkerheten til ▼Kesimpta® (ofatumumab) ble undersøkt i to fase III studier (ASCLEPIOS I og II) med identisk design. Tidligere resultater på hele den relapserende MS populasjonen viste signifikant bedre klinisk- og MR-utfall for Kesimpta® (ofatumumab)-behandlede pasienter enn de som ble behandlet med teriflunomid [ClinicalTrials.gov (NCT02792218 og NCT02792231)].1
ASCLEPIOS I og II-studiene sammenlignet ofatumumab (ASCLEPIOS I, n = 465, ASCLEPIOS II, n = 481) med teriflunomid (ASCLEPIOS I, n = 462, ASCLEPIOS II, n = 474). Deltakerne var mellom 18 og 55 år, med Expanded Disability Scale (EDSS) skår mellom 0 og 5,5.1 Studiene ble gjennomført på 385 studiesteder i 37 land.1 ASCLEPIOS I- og II-studiene bestod av både behandlingsnaive og tidligere behandlede pasienter.1 Av totalt antall studiedeltakerne med relapserende MS, så var 32,7 % nydiagnostiserte og behandlingsnaive.2
Metode:
Nydiagnostiserte og behandlingsnaive deltakere ble randomisert til behandling med ofatumumab 20 mg subkutan injeksjon hver fjerde uke, eller teriflunomid 14 mg tablett en gang per dag opptil 30 måneder. Endepunktene som ble analysert i den pre-definerte protokollen for nylig diagnostiserte og behandlingsnaive deltakere inkluderte årlig attakkrate [annualized relapse rate (ARR)], bekreftet sykdomsforverring [confirmed disability worsening (CDW)], progresjon uavhengig av attakk-aktivitet [progression independent of relapse activity (PIRA)] og bivirkninger.2
Resultater:
Totalt ble data for 615 nylig diagnostiserte og behandlingsnaive deltakere analysert (ofatumumab: n = 314; teriflunomid: n = 301). De nydiagnostiserte og behandlingsnaive hadde gjennomsnittlig alder på 26,2 år og EDSS-skår på 2,2. Median studielengde var på 1,7 år for de som ble behandlet med ofatumumab, og 1,6 år for de som ble behandliet med teriflunomid. Nitti prosent av pasientene ble behandlet i mer enn ett år, og mer enn 25 % av deltakerne ble behandlet mer enn to år. Sammenligning av behandlingsgruppene med den totale fase III-ASCLEPIOS populasjonen viste at de nylig diagnostiserte og behandlingsnaive deltakerne var yngre og hadde lavere funksjonsnedsettelses-skår og lavere total T2-lesjonsvolum. Studiedeltakerne hadde en median tid fra diagnose til behandling med ofatumumab på 0,35 år: Median tid fra diagnose til behandling med teriflunomid var 0,36 år. De nydiagnostiserte og behandlingsnaive deltakerne hadde en gjennomsnittlig sykdomsvarighet på 1,4 år og en median Expanded Disability Status Scale (EDSS) score på 2,0 ved baseline.2 Subpopulasjonen av nylig diagnostiserte og behandlingsnaive deltakere, ble definert som de deltakerne som hadde fått en RMS-diagnose innen 36-månedersperioden før screening og som ikke hadde noen tidligere behandling med en DMT.
Tabell 1: Karakteristika av nydiagnostiserte og behandlingsnaive og i den totale RMS populasjonen i fase III ASCLEPIOS I/II-studiene. Tabell utarbeidet av Novartis basert på Gärtner et al.2 og Hauser et al.1
Effektendepunkt:
Årlig attakkrate (primært endepunkt)
Årlig attakkrate ble definert som bekreftede MS-attakker observert i studien, standardisert til 1 år.
Sammenlignet med teriflunomid, reduserte Kesimpta® årlig attakkrate med 50,3 % (rate ratio (95 % konfidensintervall (KI)): 0,50 (0,33, 0,74); p < 0,001).2
Figur 1: Årlig attakkrate var antall bekreftete MS-attakker observert under studien, standardisert til 1 år. Ofatumumab reduserte årlig attakkrate med 50% versus terilunomid (ARR: 0,09 vs. 0,18; rate ratio (95% konfidensintervall; KI): 0,50 (0,33, 0,74); p < 0.001) Figur utarbeidet av Novartis basert på Gärtner et al.4
MR-endepunkt (sekundære endepunkt)
Kesimpta® (ofatumumab) reduserte også antall Gd-forsterkende T1-lesjoner med 95,4 % (0,02 vs 0,39; P < 0,001) og reduserte nye eller forstørrede T2-lesjoner med 82,0 % (0,86 vs 0,78; P < 0,001) versus teriflunomid.2
Figur 2: Panel A, Ofatumumab reduserte gjennomsnittlig Gd+ T1 -lesjoner per scann fra baseline til slutten av studien med 95% versus teriflunomid (0,02 vs. 0,39; rate ratio (95% KI): 0,05 (0,02,0,10); p < 0,001); Panel B, Ofatumumab reduserte årlig rate av nye eller forstørrede T2-lesjoner med 82% versus teriflunomid; Panel C, Ofatumumab reduserte antall T2-lesjoner med 97% versus teriflunomid fra baseline til år 2. Figur utarbeidet av Novartis basert på Gärtner et al.4
Bekreftet symdomsforverring (sekundært endepunkt)
3- eller 6-måneders sykdomsforverring var definert fra baseline EDSS skår med > 1,5 poeng for skår 0, > 1poeng for skår 1-5, og > 0,5 poeng for skår > 5,5 vedvarende for minst henholdsvis 3 eller 6 måneder.
Pasienter behandlet med Kesimpta hadde en relativ risikoreduksjon på 38 % (P = 0,065) på 3-måneders bekreftet sykdomsforverring [Confirmed Disability Worsening (CDW)] og en relativ risikoreduksjon på 46 % (Hazard ratio (HR; 95 % KI): 0,54 (0,30, 0,98); p = 0,044) på 6-måneders bekreftet sykdomsforverring.
Figur 3: Kaplan-Meier estimater av andel pasienter med bekreftet sykdomsforverring. Panel A, Tid til 3 måneders bekreftet sykdomsforverring (3mCDW). Ofatumumab reduserte risikoen for 3mCDW med 38% (hazard ratio (HR) (95% KI): 0,62 (0,37, 1,03); p = 0,065) versus teriflunomid. Panel B, Tid til 6 måneders bekreftet sykdomsforverring (3mCDW). Ofatumumab reduserte risikoen for 6mCDW med 46% (hazard ratio (HR) (95% KI): 0,54 (0,30, 0,98); p = 0,98) versus teriflunomid. Figur utarbeidet av Novartis basert på Gärtner et al.4
NEDA-3 (sekundært endepunkt)
NEDA-3 kriteriene er et komposittendepunkt bestående av ingen bekreftede attakker, ingen 6-måneders bekreftet sykdomsforverring, og ingen MR-aktivitet. Ofatumumab økte signifikant oddsen for å oppnå NEDA-3 versus teriflunomid i alle studieperioder (Figur 4).
Figur 4: NEDA-3 delt opp i de ulike studieperiodene. Måned 0-12: Antall deltakere som oppnådde NEDA-3; ofatumumab: 134/285 (47 %); teriflunomid: 71/288 (24,7). Oddsratio (95 % KI): 3,31 (2,24, 4,90). Måned 12-24: Antall deltakere som oppnådde NEDA-3; ofatumumab: 258/280 (92,1 %); teriflunomid: 131/280 (46,8%). Oddsratio (95% KI): 14,68 (8,76, 24,61). Måned 0-24: Antall deltakere som oppnådde NEDA-3; ofatumumab: 127/285 (44,6%); teriflunomid: 51/288 (17,7 %). Oddsratio (95 % KI): 4,63 (3,05, 7,03). En modifisert fullt analysesett ble brukt for analyse av NEDA, og den inkluderte alle deltakerne i i det fulle analysesett ble analysert tråd med intent-to-treat-prinsippet. NEDA, No Evidence of Disease Activity. Figur utarbeidet av Novartis basert på Gärtner et al.4
PIRA (Sykdomsprogresjon uavhengig av attakker [progression independent of relapse activity])
Kesimpta forsinket 6-måneders PIRA med 56% (HR: 0,44 (0,20, 1,00); p = 0,049).
Nevrofilament lettkjede [neurofilament light chain, NfL]
Nevrofilament lettkjede (NfL) er et protein som utgjør en del av strukturen til nerveceller. Når nerveceller blir skadet, frigjøres NfL til blodet og cerebrospinalvæsken. Nivåene av NfL indikere graden av nerveskade og betennelse ved nevrologiske sykdommer som MS, og NfL brukes som markør på skade av aksonene.3
Det var ingen signifikant forskjell i gjennomsnittlig serum nevrofilament lettkjede-konsentrasjon (NfL) mellom ofatumumab og teriflunomid ved måned 3 (8,72 vs. 9,13 pg/ml; ratio (95 % KI): 0,95 (0,88, 1,03); p = 0,258). Imidlertid var gjennomsnittlig serum NfL-konsentrasjon signifikant lavere (begge p < 0,001) i ofatumumab-gruppen enn i teriflunomid-gruppen ved måned 12 (6,60 vs. 8,61 pg/ml; forhold (95 % KI): 0,77 (0,71, 0,83)) og måned 24 (6,47 vs. 8,10 pg/ml; forhold (95 % KI): 0,80 (0,74, 0,86)).2
Sikkerhetsprofil
Bivirkninger er oppsummering i tabell 2. Tilsvarende andel av deltakerne opplevde bivirkninger i begge behandlingsgrupper (ofatumumab 94,7 %; teriflunomid 86 %). Bivirkninger hos minst 10 % av deltakerne med ofatumumab var nasofaryngitt, systemiske injeksjonsrelaterte reaksjoner, hodepine og øvre lufteveisinfkesjoner; og med teriflunomid var de nasofaryngitt, alopecia (hårtap), infeksjon i øvre lufteveier, systemiske injeksjonsreaksjoner, hodepine og fatigue. Alvorlige bivirkninger (SAE) ble rapportert hos 22 deltakere (7,0 %) som fikk ofatumumab og hos 16 deltakere (5,3 %) som fikk teriflunomid. Det var ingen dødsfall.2
Tabell 2: Bivirkninger hos nydiagnostiserte og behandlingsnaïve og i den totale RMS-gruppen. Tabell utarbeidet av Novartis basert på Gärtner et al.2 og Hauser et al.1
Systemiske injeksjonsreaksjoner
Av systemiske injeksjonsreaksjoner, så var 98,8% var milde til moderate i alvorlighetsgrad
Infeksjoner
Tilsvarende andeler av deltakerne i begge behandlingsgruppene opplevde infeksjoner (ofatumumab, 56,1 %; teriflunomide, 56,5 %) (Tabell 2). Nasofaryngitt og infeksjon i øvre luftveier var de vanligste og var hovedsakelig milde til moderate i alvorlighetsgrad. Seks deltakere (1,9 %) som fikk ofatumumab og to (0,7 %) som fikk teriflunomid fikk alvorlige infeksjoner. Ingen opportunistiske infeksjoner ble rapportert.
Andre sikkerhetsfunn
To tilfeller av kreft (0,6 %) ble rapportert i ofatumumab-gruppen, og ett tilfelle (0,3 %) i teriflunomid-gruppen (alle basaliom). Ingen medfødte abnormiteter eller fødselsdefekter ble rapportert blant deltakerne som ble eksponert for behandling under graviditet (ofatumumab: to deltakere; teriflunomid: tre deltakere). Neutropeni, en kjent risiko assosiert med teriflunomid, forekom hyppigere i teriflunomid-gruppen (fire deltakere) enn i ofatumumab-gruppen (to deltakere).
B-cellenivå
Ofatumumab-gruppen oppnådde raskt en reduksjon i B-celler under nedre grense for normalt (LLN) (40 celler/µl). Ved uke 2 hadde 97 % av deltakerne B-celle nivåer under LLN, og denne andelen holdt seg konstant frem til slutten av studien. B-celle reduksjon på mindre enn eller lik 10 celler/µl ble oppnådd for 90 % av pasientene innen uke 4, og 98 % av pasientene innen uke 12 (Supplerende figur 2). Effekten av ofatumumab på B-celle reduksjon var konsistent på tvers av vektkvartilene. Etter siste dose ofatumumab hos deltakere som avsluttet behandlingen av hvilken som helst årsak, ble det observert gjenoppbygging av B-celler (nivåer over LLN) hos 12 av 27 deltakere (44 %) innen uke 24, 13 av 21 (62 %) innen uke 36, 6 av 8 (75 %) innen uke 48 og 8 av 8 (100 %) innen uke 60.
Etterlevelse (compliance)
Etterlevelse med behandlingen var høy i begge behandlingsgrupper (Tabell 1). Etterlevelse av behandlingen på Kesimpta samsvarte med funnene fra den fulle relapserende MS-populasjonen i ASCLEPIOS I/II.1 Fra femte injeksjon, så injiserte 48 til 95 % av pasientene Kesimpta® selv hjemme, og dette økte til 60 til 95 % fra 10.injeksjon.
Tabell 3: Det var høy etterlevelse i begge behandlingsgrupper, og 100% etterlevelse ble oppnådd av 171 av 314 (54,5) i ofatumumabgruppen, og 176 av 301 (58,5 %) i teriflunomid-gruppen.Minst 90 % etterlevelse ble oppnådd hos 307 av 314 (97,8 %) hos deltakerne som fikk ofatumumab. Prosentandel etterlevelse ble beregnet i sikkerhetsgruppen som varigheten av eksponering for studiemedisin (dager) delt på behandlingsvarighet (dager).2 Tabell utarbeidet av Novartis basert på Gärtner et al.4
|
Behandlingsgruppe |
Etterlevelse |
Median eksponering legemiddel |
|
ofatumumab |
98,8% |
1,7 år |
|
teriflunomid |
98,9% |
1,6 år |
Konklusjon
For ofatumumab-behandlede pasienter var det en nesten fullstendig opphevelse av inflammatorisk sykdomsaktivitet og ingen uventede sikkerhetssignaler. Ofatumumab økte sjansen for at pasienter oppnådde NEDA-3, både det første året og andre året med behandling versus teriflunomid. Sikkerhetsprofilen på ofatumumab hos nylig diagnostiserte, behandlingsnaive subruppen samsvarte med den totale ASCLEPIOS I/II-studiepopulasjonen uten nye sikkerhetssignal. En gunstig nytte/risiko-profil av ofatumumab versus teriflunomid støtter ofatumumab som første behandling ved MS-diagnose for nylig diagnostiserte og behandlingsnaive personer med MS.