Kisqali har nå fått EMA-godkjennelse for behandling av adjuvant brystkreft. Denne utvidelsen av indikasjonen bygger på Kisqalis tidligere godkjenning og status som anbudsvinner innen metastatisk (HR)-positiv, human epidermal vekstfaktorreseptor 2 (HER2)-negativ brystkreft1.
Indikasjon for tidlig brystkreft
Kisqali, i kombinasjon med en aromatasehemmer, er indisert til adjuvant behandling av pasienter med HR+/HER2- tidlig brystkreft med høy risiko for tilbakefall. Hos pre- eller perimenopausale kvinner, eller menn, skal aromatasehemmeren kombineres med en luteiniserende hormonfrigjørende hormon (LHRH)-agonist.2
Denne nye indikasjonen gjelder for pasienter i tidlige stadier av brystkreft og vil bli brukt for å redusere risikoen for tilbakefall. De fleste pasientene oppdages tidlig gjennom Norges mammografiprogram, som sikrer at kreften ikke har spredd seg. Vanligvis får disse pasientene først kirurgi for å fjerne kreften, etterfulgt av tilleggsbehandling for å hindre tilbakefall. Kisqali er nå godkjent som en slik tilleggsbehandling.


NATALEE-studien
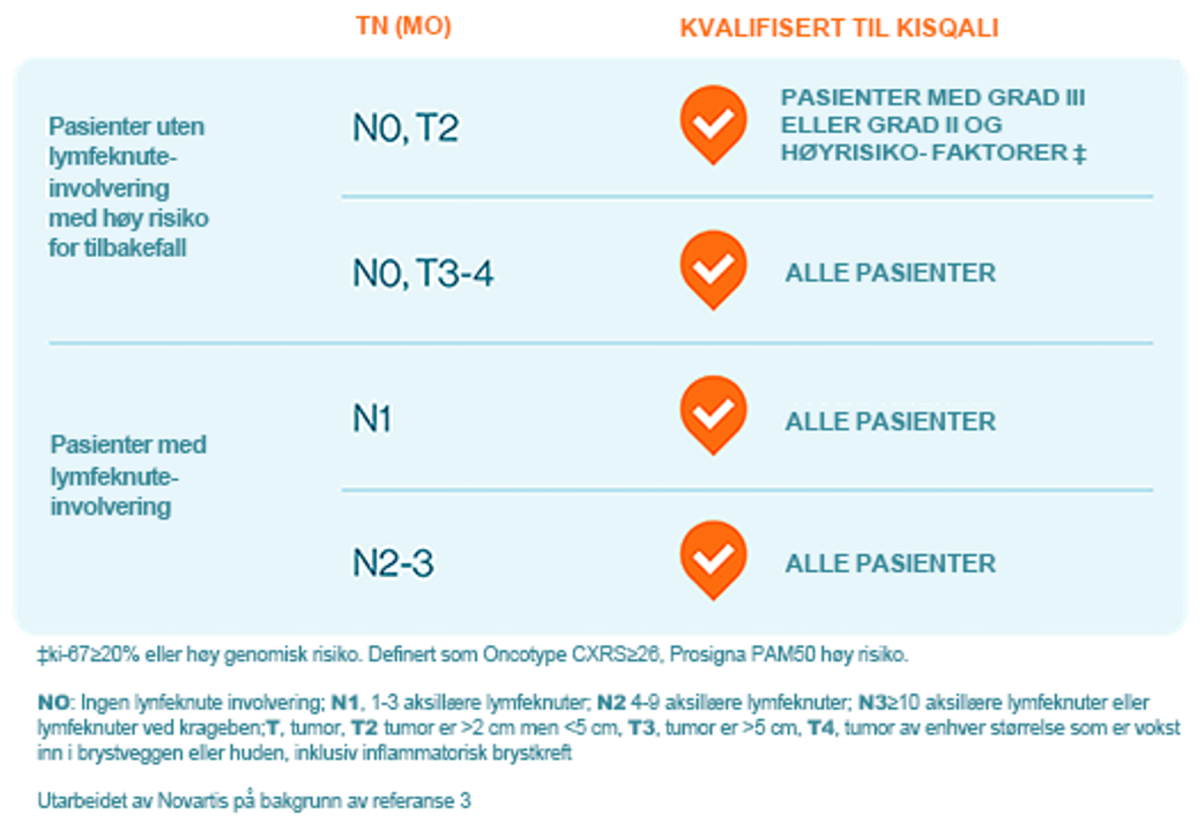
Hovedfunnet fra NATALEE-studien var at Kisqali, i kombinasjon med standard behandling for tidlig brystkreft, reduserer risikoen for tilbakefall sammenlignet med standard behandling alene.3 Ved bruk av TNM kriterier inkluderte NATALEE-studien pasienter med enhver lymfeknuteinvolvering (unntatt mikroskopisk lymfeknuteinvolvering), eller hvis ingen lymfeknuteinvolvering, enten tumorstørrelse > 5 cm eller tumorstørrelse 2-5 cm med enten grad 2 (og høy genomisk risiko eller Ki67 ≥ 20 %) eller grad 3.3
Viktige resultater
- Studien viste en betydelig og klinisk meningsfull 25,1 % (HR=0,749; 95 % CI: 0,628, 0,892; P = 0.0012) reduksjon i risikoen for sykdomsresidiv hos pasienter med HR+/HER2- stadium II og III eBC behandlet med adjuvant Kisqali pluss endokrin terapi (ET) sammenlignet med ET alene, etter 3 års oppfølging.3
- En konsekvent, klinisk meningsfull fordel i invasiv sykdomsfri overlevelse (iDFS) ble også observert på tvers av spesielt forhåndsbestemte undergrupper, inkludert stadium (II/III) og lymfeknutestatus (positiv/negativ).3
- Behandlingen er den eneste CDK4/6 hemmeren som viser klinisk relevant effekt på toppen av dagens standardbehandling hos høy-risiko stadium II og III pasienter som ikke har spredning til lymfeknutene.3
- Kisqali ved en dose på 400 mg var godt tolerert av pasientene, med bivirkninger hovedsakelig av mild art. 3
Utvalgt sikkerhetsinformasjon
Kisqali er kontraindisert ved overfølsomhet for innholdsstoffene, peanøtter eller soya.
Kisqali bør unngås ved eksisterende eller signifikant risiko for utvikling av QTC-forlengelse.
Kisqali metaboliseres hovedsakelig av CYP3A4 og dosereduksjoner kan være aktuelt. Behandlingen med Kisqali krever monitorering under de første behandlingssyklusene.
Eldre >65 år: Dosejustering ikke nødvendig. Kan tas med eller uten mat.2
Referanser:
1. Kisqali - opinion on variation to marketing authorisation | European Medicines Agency (EMA)
2. Preparatomtale Kisqali
3.G.N. Hortobagyi, et al., A phase III trial of adjuvant ribociclib plus endocrine therapy versus endocrine therapy alone in patients with HR-positive/HER2-negative early breast cancer: final invasive disease-free survival results from the NATALEE trial, Annals of Oncology, 2024, ISSN 0923-7534, https://doi.org/10.1016/j.annonc.2024.10.015.
