Fase 2-studie APLIOS [1]
APLIOS (NCT03560739) var en 12-ukers, ublindet, parallellgruppe, fase 2-studie som inkluderte 256 pasienter med relapserende MS (RMS) (autoinjektor* abdomen, n=128; ferdigfylt sprøyte abdomen, n=128)
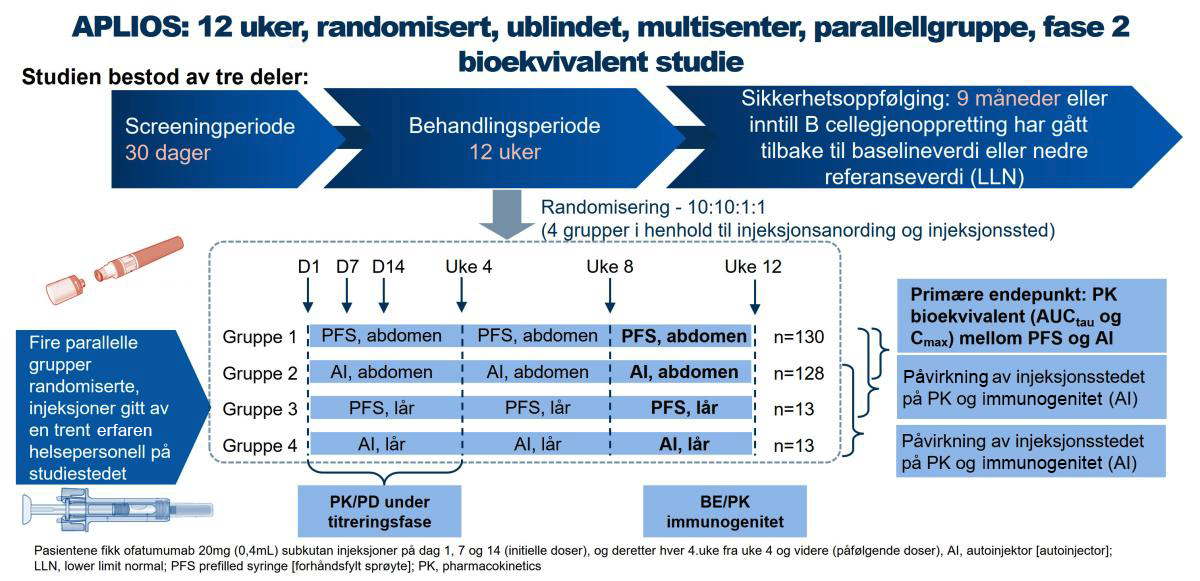
Figur 1: Design av APLIOS fase 2 bioekvivalent studie. Figur utarbeidet av Novartis basert på Bar-Or A1
Studiens hensikt:
Studiens primære hensikt var å undersøke bioekvivalensen av 20mg ofatumumab administrert av en autoinjektor versus en ferdigfylt sprøyte. Sekundære endepunkt var å undersøke sikkerhet og tolerabilitet. Studiens eksplorative endpunkt var også å undersøkte effekten på B-celledeplesjon og MR-lesjonsaktivitet assosiert med ofatumumab-behandling.
Tabell 1: Baseline og sykdomskarakteristika APLIOS fase 2-studien

Nøkkelresultater:
- I løpet av doseringsintervallet (uke 8–12) var den abdominale farmakokinetiske eksponeringen for ofatumumab bioekvivalent for autoinjektor og ferdigfylt sprøyte (geometrisk gjennomsnitt AUCτ, 487,7 vs 474,1 t × μg/ml [forhold 1,03]; Cmax, 1,1409 vs. 1,00])
- Plasmakonsentrasjonene av ofatumumab ved hvert tidspunkt var like på tvers av grupper uavhengig av administrasjonsutstyr eller injeksjonssted
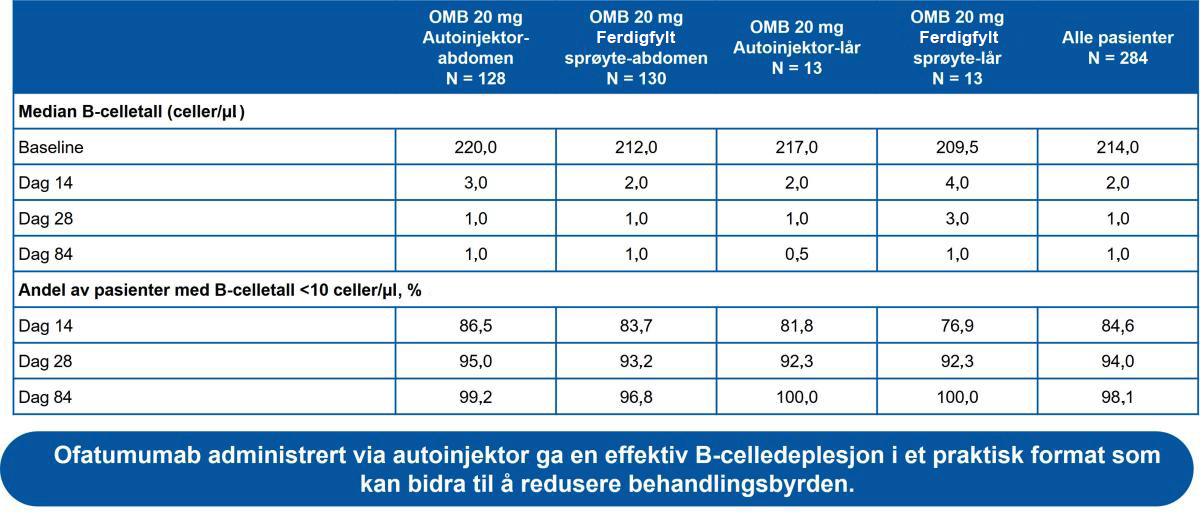
- Median B-celletall ble raskt redusert i alle grupper fra 214,0 celler/μl ved baseline til 2,0 celler/μl på dag 14; B-celledeplesjon var lik på tvers av alle kroppsvektkvartiler (Figur 2)
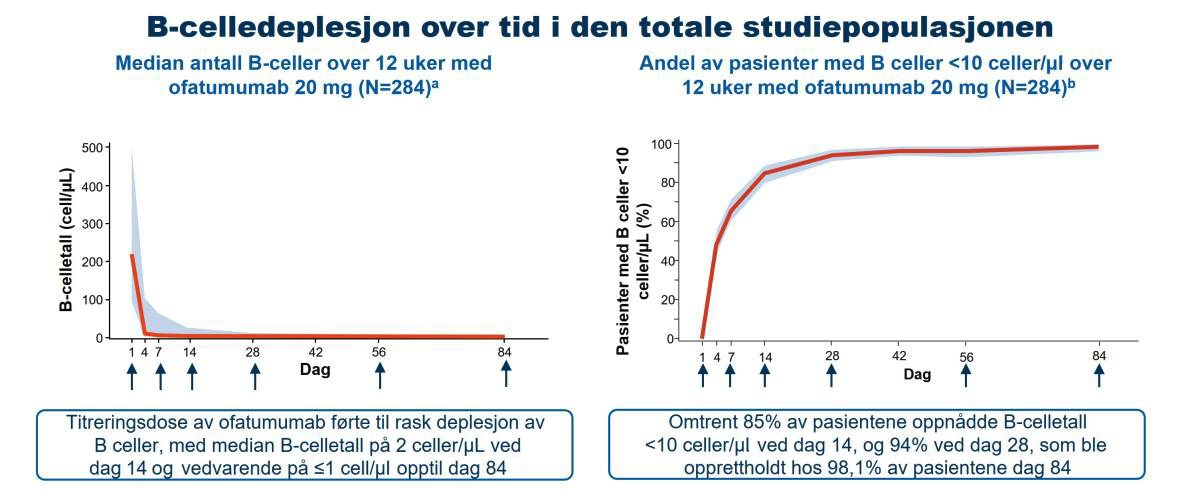
Figur 2: Ofatumumab resulterte i en rask, nær fullstendig og vedvarende B-celledeplesjon. Piler: Doseadministrasjon. Analysen tok for seg data inntil 30 dager etter siste injeksjon. a: Det skraverte båndet markerer 5–95 persentilområdet for observasjoner. b: Det skraverte båndet markerer 95 % KI beregnet ved bruk av Clopper-Pearson-metoden på hvert tidspunkt merket på X-aksen.
- Den totale forekomsten av bivirkninger og alvorlige bivirkninger i studiepopulasjonen var henholdsvis 57,4 % og 2,1 %; de fleste bivirkningene (97,5 %) var grad 1/2; Grad 3 bivirkninger ble observert hos 2,5 % av pasientene. Ingen grad 4 bivirkninger ble observert. Ingen død skjedde under studien.
- De vanligste bivirkningene var hodepine, frysninger og feber.
Tabell 2: Bivirkninger i APLIOS.1 Tabell utarbeidet av Novartis etter Bar-Or et al 20221
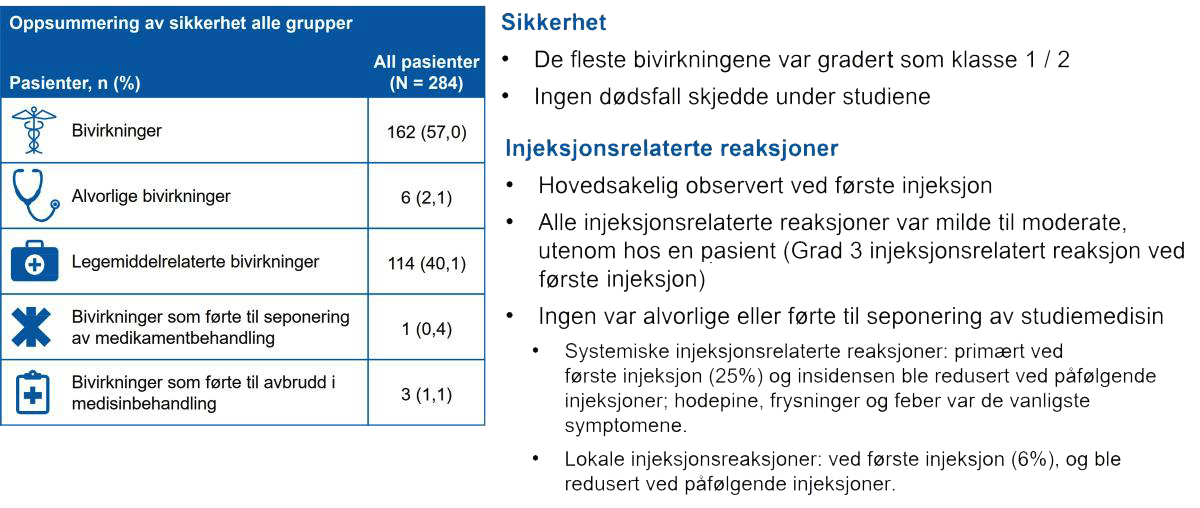
- Totalt ble infeksjoner rapportert hos 20,4 % (58/284) av pasientene, med lignende forekomst på tvers av gruppene
- MR-endepunkter: Gjennomsnittlig antall nye eller vedvarende Gd+ T1-lesjoner sank fra 1,5 ved baseline til 0,8, 0,3 og 0,1 i henholdsvis uke 4, 8 og 12. Andelen pasienter fri for Gd+ T1-lesjoner økte over tid i alle ofatumumab-gruppene
- Resultatene av testing for ofatumumab antistoff mot legemiddel (ADA) var positive hos 7/284 pasienter (2,5 %). Seks av disse pasientene hadde imidlertidig et positivt ADA-resultat ved baseline, noe som sannsynligvis gjenspeiler falske positive funn. Bare én pasient (0,4 %) som ikke hadde et positivt ADA-testresultat ved baseline, hadde et forbigående positivt ADA-testresultat ved uke åtte. Det var ingen observert innvirkning av ADA på farmakokinetisk eksponering eller B-celledeplesjon. Ingen pasienter utviklet nøytraliserende antistoffer mot ofatumumab, vurdert ved en cellebasert analyse.
MR-lesjoner over tid
Gjennomsnittlig antall (Gd+) T1-lesjoner sank fra 1,5 ved baseline til 0,8, 0,3 og 0,1 i henholdsvis uke 4, 8 og 12 (figur 3). Andelen pasienter fri for Gd+ T1-lesjoner økte over tid i alle ofatumumab-gruppene (Figur 3, B). På tvers av alle grupper var andelen pasienter fri for Gd+ T1-lesjoner ved baseline og uke 4, 8 og 12, henholdsvis 64,2 %, 66,5 %, 86,7 % og 94,1 %.
MR-endepunkt
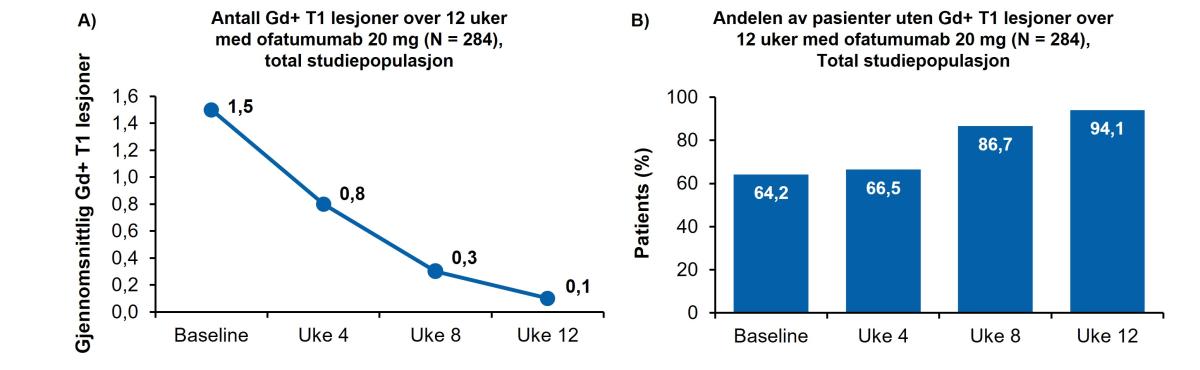
Figur 3: A, Antall Gd+ lesjoner fra baseline til uke 12. Doseringsregimet for ofatumumab reduserte raskt gjennomsnittlig antall Gd+ lesjoner fra 1,5 ved baseline til 0,1 innen uke 12. Pre-dose MR-vurderinger vises som tid 0 på x-aksen. Analysen tar for seg skanninger samlet inntil 30 dager etter siste injeksjonsdato (Figur 3 A). B, Andel av pasienter uten Gd+ T1-lesjoner over de samme 12 ukene med ofatumumab 20mg. Ofatumumab-behandling økte andelen av pasienter uten Gd+T1 lesjoner fra 64,2% ved baseline til 94,1% ved uke 12.
Tabell 3: B-celledeplesjon over tid på de ulike gruppene. Ofatumumab resulterte i rask og vedvarende, nærmest komplett B-celledeplesjon uavhengig av injeksjonsted og injeksjonsutstyr.
Konklusjon:
- Demonstrerte at ofatumumab 20 mg subkutan selvadministrering med autoinjektor er bioekvivalent til administrering med en ferdigfylt sprøyte.
- Resultatene viste at autoinjektor førte til rask B-celledeplesjon uavhengig av injeksjonssted (abdomen eller lår), og hadde en gunstig sikkerhets- og tolerabilitetsprofil, og var egnet for hjemmebasert selvadministrering.
- Bekrefter i samsvar med tidligere funn at ofatumumab, gitt i månedlige doser på 20 mg (etter initial dosering på dag 1, 7 og 14), viser gunstige egenskaper med hensyn til rask og kontinuerlig B-celledeplesjon hos pasienter med relapserende MS (RMS).
- Ofatumumab hadde en gunstig sikkerhets- og tolerabilitetsprofil tilsvarende det som er rapportert i fase 3 studiene ASCLEPIOS I/II: Majoriteten av systemiske injeksjonsrelaterte injeksjoner i APLIOS var milde til moderate i alvorlighet, og de fleste var assosiert med første injeksjon. Injeksjonsrelaterte reaksjoner med ofatumumab var sjeldnere i en indirekte sammenligningsstudie med andre anti-CD20-behandlinger, som administreres med høyere intravenøse doser og som krever premedisinering (spesielt når man sammenligner tidlige doser).4
*Det som omtales som «autoinjektor» kalles «ferdigfylt penn» i Felleskatalogen og SPC.